
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式:____________。
(2)实验装置(如图所示,量气管为碱式滴定管改装)
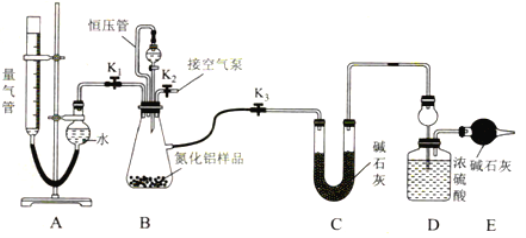
连好装置后,首先应进行的操作是________。
(3)实验过程:称得装置D的初始质量为y g;称取x g AlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为a mL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对三个活塞的操作是________。
②若无恒压管,对所测气体体积的影响是________(填“偏大”“偏小”或“无影响”)
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行调整量气管高度,使左右两边液面相平 ,若量气管中的液面高于右侧球形容器中的液面,所测气体的体积______(填“偏大”“偏小”或“无影响”)。
④记录滴定管的读数为b mL(已知:该实验条件下的气体摩尔体积为Vm L·mol-1),则Al4C3的质量分数为______(用含a、b、x、y、Vm的代数式表示)。
⑤测量AlN质量分数的数据:首先关闭活塞 K1 ,打开活塞K3,通过分液漏斗加入过量___,与装置B瓶内物质充分反应;反应完成后,____(填入该步应进行的操作),最后称得装置D的质量为z g。
【答案】AlN+NaOH+H2O=NaAlO2+NH3↑ 检查装置的气密性 关闭活塞K2、K3,打开活塞K1 偏大 偏小 ![]() ×100% NaOH溶液 打开K2,通入一段时间空气
×100% NaOH溶液 打开K2,通入一段时间空气
【解析】
(1)AlN与NaOH溶液反应生成偏铝酸钠和氨气;
(2)涉及气体的实验要检验装置气密性;
(3)①欲首先测量Al4C3质量分数,需测量Al4C3与硫酸反应生成甲烷的体积;
②若无恒压管,分液漏斗中的液体排出部分B中的空气;
③若量气管中的液面高于右侧球形容器中的液面,则球形容器中压强偏大;
④记录滴定管的读数为bm L(已知:该实验条件下的气体摩尔体积为Vm L·mol-1),生成甲烷的物质的量是![]() ;
;
⑤AlN与强碱生成氨气,氨气被D吸收,根据D的质量变化计算AlN的质量;
(1)AlN与NaOH溶液反应生成偏铝酸钠和氨气,反应方程式是AlN+NaOH+H2O=NaAlO2+NH3↑;
(2)连好装置后,首先应进行的操作检查装置的气密性;
(3)①欲首先测量Al4C3质量分数,测量Al4C3与硫酸反应生成甲烷的体积,应关闭活塞K2、K3,打开活塞K1,用排水量气法测量生成甲烷的体积;
②若无恒压管,分液漏斗中的液体排出部分B中的空气,测量甲烷的体积偏大;
③若量气管中的液面高于右侧球形容器中的液面,则球形容器中压强偏大,所测气体的体积偏小;
④记录滴定管的读数为b mL(已知:该实验条件下的气体摩尔体积为Vm L·mol-1),生成甲烷的物质的量是![]() ,根据碳元素守恒,Al4C3的物质的量是
,根据碳元素守恒,Al4C3的物质的量是![]() ,Al4C3的质量分数为
,Al4C3的质量分数为![]()
![]() 100% ;
100% ;
⑤AlN与强碱生成氨气,所以分液漏斗加入过量NaOH溶液,与装置B瓶内物质充分反应;反应完成后,打开K2,通一段时间空气,将B中氨气完全赶进D中吸收。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
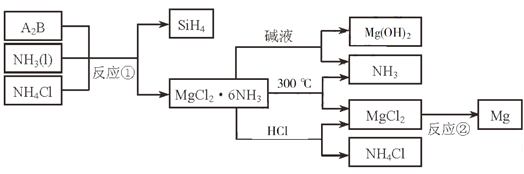
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
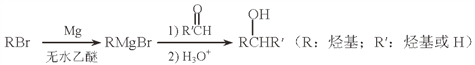
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
(1)标准状况下,0.2 mol氨气的体积是__________, 其中含有的NH3分子数是__________,
(2) 20℃时,饱和KCl溶液的密度为0.745g·cm﹣3,物质的量浓度为4.0 mol·L﹣1,则此溶液中KCl 的质量分数为______
(3)从500 mL 0.2 mol/L Na2SO4 溶液中取出10 mL,取出的Na2SO4溶液物质的量浓度为___mol/L;若将这10 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为______mol/L。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是______;ACl2的化学式是_________。
(5)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量之比为________
(6)300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶300mL,反应后溶液中SO42﹣的物质的量的浓度为__________(混合体积看成两液体体积之和)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________,该反应的平衡常数表达式K=___________
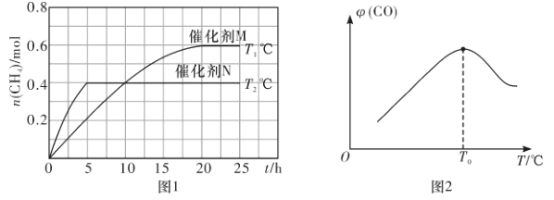
③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。T0℃时,CO的体积分数最大的原因为_________________________________。该反应的△H_______0(填“>”“<”)
)与温度(T)的关系如图2所示。T0℃时,CO的体积分数最大的原因为_________________________________。该反应的△H_______0(填“>”“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①标准状况下,1g氢气和14g氮气的体积相同
②常温常压下,16g氧气和臭氧的混合气体中含有的质子数为8NA
③0.1L 0.5mol/LCH3CH2OH溶液中含有氢原子数为0.3NA
④常温常压下,28gCO的体积大于22.4L
⑤分子总数相等的NO2和CO2,所含氧原子数均为2NA
上述表述中正确的有:_______
(2)用容量瓶配制溶液时,由于操作不当会引起误差
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
上述情况会使所配溶液浓度偏低的是 :_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品油烯(D)可用作香料的原料,它可由A合成得到如下所示,下列说法正确的是 ( )
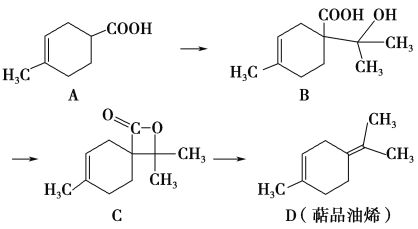
A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 1 mol有机物A中含有1.204×1024个双键
D. 有机物C的同分异构体中不可能有芳香化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 Urolithin A常用于合成某药物,其结构简式如图所示。下列说法错误的是
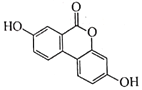
A. Urolithin A分于中苯环上的一氯代物有6种
B. Urolithin A分子中所有原子不可能共平面
C. Urolithin A能发生加成、取代和氧化反应
D. Urolithin A在稀硫酸中的水解产物含2种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)海水中蕴含的元素有80多种,它是一个巨大的宝藏。
①海水中被称为海洋元素是___。(填元素名称)
②下列物质不经过化学变化就能从海水中获得的是___。(填字母)
A.单质钠 B.单质碘 C.氯化钠
③加碘食盐中碘酸钾的化学式是___。
(2)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①在该反应的化学方程式上用双线桥标出电子转移的方向和数目___。
②该反应中浓盐酸表现的性质有___。
③如反应中转移了20mol电子,则产生的Cl2在标准状况下体积为__ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com