
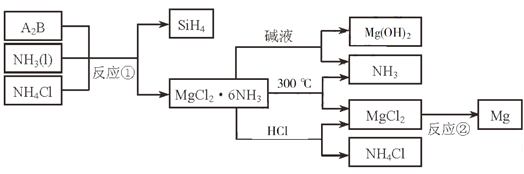
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
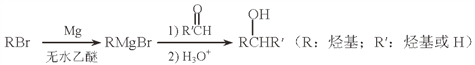
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
【答案】r(H+)<r(Mg2+)<r(N3–)<r(Cl–)第三周期ⅡA族![]() Mg2Si熔融,电解NH3,NH4ClSiC2Mg(OH)2+2SO2+O2=2MgSO4+2H2OCH3CH2CHO,CH3CHO
Mg2Si熔融,电解NH3,NH4ClSiC2Mg(OH)2+2SO2+O2=2MgSO4+2H2OCH3CH2CHO,CH3CHO
【解析】
根据反应的流程过程,先判断出A2B的化学式,带入框图,结合学习过的相关知识进行分析即可。
(1)MgCl2·6NH3所含元素的简单离子为Mg2+、Cl、N3-、H+,比较离子半径应该先看电子层,电子层多半径大,电子层相同时看核电荷数,核电荷数越大离子半径越小,所以这几种离子半径由小到大的顺序为:r(H+)<r(Mg2+)<r(N3–)<r(Cl–)。Mg在周期表的第三周期ⅡA族。氢氧化镁是离子化合物,其中含有1个Mg2+和2个OH-,所以电子式为:![]() 。
。
(2)根据元素守恒,A2B中就一定有Mg和Si,考虑到各自化合价Mg为+2,Si为-4,所以化学式为Mg2Si。反应②是MgCl2熔融电解得到单质Mg,所以必备条件为:熔融、电解。反应①需要的是Mg2Si、NH3和NH4Cl,而后续过程又得到了NH3和NH4Cl,所以可以循环的是NH3和NH4Cl。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料,该耐磨材料一定有Si和C,考虑到课本中介绍了碳化硅的高硬度,所以该物质为SiC。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,二氧化硫是酸性氧化物与氢氧化镁这样的碱应该反应得到盐(亚硫酸镁),考虑到题目要求写出得到稳定化合物的方程式,所以产物应该为硫酸镁(亚硫酸镁被空气中的氧气氧化得到),所以反应为:2Mg(OH)2+2SO2+O2=2MgSO4+2H2O。
(5)利用格氏试剂可以制备![]() ,现在要求制备
,现在要求制备![]() ,所以可以选择R为CH3CH2,R’为CH3;或者选择R为CH3,R’为CH3CH2,所以对应的醛R’CHO可以是CH3CH2CHO或CH3CHO。
,所以可以选择R为CH3CH2,R’为CH3;或者选择R为CH3,R’为CH3CH2,所以对应的醛R’CHO可以是CH3CH2CHO或CH3CHO。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】某化合物M由两种常见的元素组成,为了测定其组成进行如下实验:
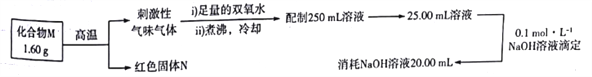
M的化学式可能为( )
A. Cu2S B. CuS C. FeS2 D. Fe3S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60具有完美的球形结构。之后Si60、N60等球形分子被不断制备出来。回答下列问题:
(1)Si的核外电子排布式为_______,C和N元素中第一电离能较大的是_______。
(2)富勒烯衍生物具有良好的光电性能,富勒烯(C60)的结构如右图所示,C60属于___晶体;C60分子中五元环与六元环的数目比为_____。
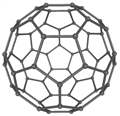
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
(3)N60的晶体中存在的作用力有_____(填字母标号)
A.共价键 B.离子键 C.氢键
D.范德华力 E.配位键 F.金属键
(4)立方氮化硼(BN)可做磨料,其结构与金刚石相似,二者具有相似性结构的原因是_______。
(5)金属M(相对原子质量为m)与N60形成的化合物晶体结构如右图所示(其中白球代表N60,黑球代表金属M),若其晶胞边长为k pm,NA代表阿伏加德罗常数的值,则其密度为______g·cm-3,该化合物中N60的配位数为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度, ![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中(假定不考虑水解因素)仅含有K+、Mg2+、SO42-、NO3-四种离子,其中K+与Mg2+的个数之比为4∶5,则NO3-与SO42-的物质的量浓度之比一定不是
A.8∶3B.3∶2C.2∶3D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池反应原理如图所示,下列说法正确的是
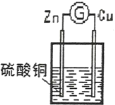
A. 在溶液中,SO42-移向正极 B. 在溶液中,电子从锌片流向铜片
C. 一段时间后,溶液颜色变浅 D. 负极电极反应式为:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在一定条件下反应生成NH3(g),过程如下图,下列说法正确的是
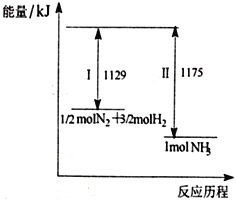
A. I为放热过程、Ⅱ为吸热过程
B. 1/2 molN2和3/2molH2的键能之和大于1 mol NH3的键能
C. 1/2molN2和3/2molH2所具有的能量之和低于1 mol NH3所具有的能量
D. 该过程的热化学反应方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入足量的活性炭和一定量的NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=____________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___________(填“升高”或“降低”),△H______0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_________________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com