
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入足量的活性炭和一定量的NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=____________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___________(填“升高”或“降低”),△H______0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_________________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
【答案】 0.042 4.0 BC 降低 < 2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-122.7 kJ·mol-1 CH3OCH3 -12e- + 16OH- = 2CO32- + 11H2O 1:2或0.5 0.11mol/L
CH3OCH3(g)+3H2O(g) △H=-122.7 kJ·mol-1 CH3OCH3 -12e- + 16OH- = 2CO32- + 11H2O 1:2或0.5 0.11mol/L
【解析】试题分析:本题考查化学反应速率和化学平衡常数的计算,外界条件对化学平衡的影响,盖斯定律的应用,燃料电池电极反应式的书写,电离平衡常数的计算,与溶度积有关的计算。
(1)①在0~10min内的平均反应速率υ(N2)=(0.42mol/L-0mol/L)![]() 10min=0.042mol/(L·min)。20min~30min各物质的物质的量浓度不变,说明反应已经达到平衡,即平衡时NO、N2、CO2物质的量浓度依次为0.40mol/L、0.80mol/L、0.80mol/L,该反应的平衡常数K=[c(N2)·c(CO2)]/c2(NO)=
10min=0.042mol/(L·min)。20min~30min各物质的物质的量浓度不变,说明反应已经达到平衡,即平衡时NO、N2、CO2物质的量浓度依次为0.40mol/L、0.80mol/L、0.80mol/L,该反应的平衡常数K=[c(N2)·c(CO2)]/c2(NO)=![]() =4。
=4。
②30min后改变一个条件,40min时NO、N2、CO2的浓度都变为30min时的1.5倍。A项,加入合适的催化剂,平衡不移动,各物质物质的量浓度不变,不可能;B项,适当缩小容器的体积,平衡不移动,但各物质物质的量浓度成比例增大,可能;C项,通入一定量的NO,由于C是固体,相当于增大压强,平衡不移动,但各物质物质的量浓度成比例增大,可能;D项,加入一定量的活性炭,由于C是固体,平衡不移动,各物质物质的量浓度不变,不可能;答案选BC。
③30min时NO、N2、CO2的浓度之比为0.40:0.80:0.80=1:2:2,升高温度NO、N2、CO2的浓度之比为2:3:3,即升高温度平衡向逆反应方向移动,则达到新平衡时NO的转化率降低,逆反应为吸热反应,ΔH![]() 0。
0。
(2)将反应编号,
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=-49.1 kJ·mol-1(①式)
CH3OH(g)+H2O(g) ΔH1=-49.1 kJ·mol-1(①式)
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1(②式)
CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1(②式)
应用盖斯定律,①式![]() 2+②式得2CO2(g)+6H2(g)
2+②式得2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)ΔH=2ΔH1+ΔH2=2
CH3OCH3(g)+3H2O(g)ΔH=2ΔH1+ΔH2=2![]() (-49.1kJ/mol)+(-24.5kJ/mol)=-122.7kJ/mol,反应的热化学方程式为2CO2(g)+6H2(g)
(-49.1kJ/mol)+(-24.5kJ/mol)=-122.7kJ/mol,反应的热化学方程式为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)ΔH=-122.7kJ/mol。
CH3OCH3(g)+3H2O(g)ΔH=-122.7kJ/mol。
(3)二甲醚氧气电池中电解质为KOH溶液,负极二甲醚被氧化成
(4)①H2CO3的电离方程式为H2CO3![]() H++HCO3-、HCO3-
H++HCO3-、HCO3-![]() H++CO32-,K2(H2CO3)=[c(H+)·c(CO32-)]/c(HCO3-),则c(CO32-):c(HCO3-)= K2(H2CO3)/c(H+)=5
H++CO32-,K2(H2CO3)=[c(H+)·c(CO32-)]/c(HCO3-),则c(CO32-):c(HCO3-)= K2(H2CO3)/c(H+)=5![]() 10-11
10-11![]() (1
(1![]() 10-10)=1:2。
10-10)=1:2。
②n(BaSO4)=![]() =0.02mol,沉淀转化的离子方程式为BaSO4(s)+CO32-(aq)
=0.02mol,沉淀转化的离子方程式为BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),该反应的平衡常数K=c(SO42-)/c(CO32-)=Ksp(BaSO4)/Ksp(BaCO3)=1
BaCO3(s)+SO42-(aq),该反应的平衡常数K=c(SO42-)/c(CO32-)=Ksp(BaSO4)/Ksp(BaCO3)=1![]() 10-11
10-11![]() (1
(1![]() 10-10)=0.1;根据离子方程式,当BaSO4固体全部转化时消耗CO32-物质的量为0.02mol,生成的SO42-物质的量为0.02mol,溶液中c(SO42-)=0.02mol
10-10)=0.1;根据离子方程式,当BaSO4固体全部转化时消耗CO32-物质的量为0.02mol,生成的SO42-物质的量为0.02mol,溶液中c(SO42-)=0.02mol![]() 2L=0.01mol/L,溶液中c(CO32-)= c(SO42-)/K=0.01mol/L
2L=0.01mol/L,溶液中c(CO32-)= c(SO42-)/K=0.01mol/L![]() 0.1=0.1mol/L;所用Na2CO3物质的量浓度至少为0.02mol
0.1=0.1mol/L;所用Na2CO3物质的量浓度至少为0.02mol![]() 2L+0.1mol/L=0.11mol/L。
2L+0.1mol/L=0.11mol/L。


科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
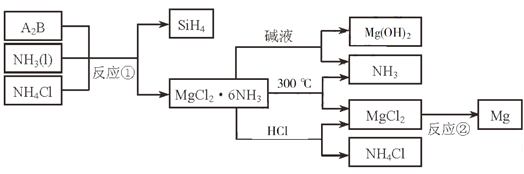
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
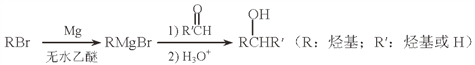
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年1月11日,中国研制的第四代隐形战机歼-20在成都首次公开试飞成功。隐形战机的核心材料是金属钛,我国探明储量世界第一。下列有关推断不正确的是( )
A. 钛的原子序数为22 B. 钛位于元素周期表第四周期
C. 钛原子核外电子排布式为1s22s22p63s23p63d4 D. 钛属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图a所示(部分产物已略去)。
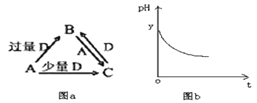
(1)若A为非金属单质,它的组成元素是形成物质种类最多的元素,D是空气的主要成分之一。请写出B的电子式_____________________________________________。
(2)若A为使用最广泛金属的单质,D是某强酸的稀溶液,则反应B+A![]() C的离子方程式为:__________________________________________________。
C的离子方程式为:__________________________________________________。
(3)若A为强碱,D为形成酸雨的气态氧化物。常温时将B的水溶液露置于空气中一段时间,其pH变化如图b所示,则其pH变化的原因是__________________。
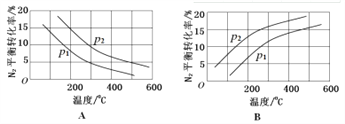
II.(1)对于合成氨反应:N2(g) +3H2(g) ![]() 2NH3(g) △H= -92.4kJ/mol。在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下列图示正确的是_________(填“A”或“B”);比较p1、p2的大小关系:_____________。
2NH3(g) △H= -92.4kJ/mol。在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下列图示正确的是_________(填“A”或“B”);比较p1、p2的大小关系:_____________。
(2)尿素是一种高效化肥,与水在一定条件下可以生成氨气:CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的是___________(填序号)。
2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的是___________(填序号)。
A.在平衡体系中再加入少量CO(NH2)2,平衡正向移动
B.降低温度使尿素的转化率减小
C.从反应开始到达到平衡时容器中混合气体的平均相对分子质量始终保持不变
D.恒温恒容时,向平衡体系中再充入少量氨气,平衡常数减小
(3)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

NH3·H2O的电离常数为_____________________________(已知lg1.8 = 0.26)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A.含20.0gNaOH的稀溶液与足量稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol
B.已知热化学方程式:SO2(g)+ ![]() O2(g)
O2(g) ![]() SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol
D.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.31kJ·mol-1 , 故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)=H2O(1)+BaSO4(s) △H<-57.31kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH 溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )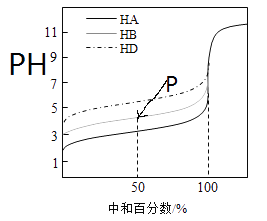
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,化学键类型和分子立体构型皆相同的是( )
A. CO2和SO2 B. CH4和SiH4 C. BF3和PH3 D. HCl和NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com