
【题目】下列物质中,化学键类型和分子立体构型皆相同的是( )
A. CO2和SO2 B. CH4和SiH4 C. BF3和PH3 D. HCl和NH4Cl
科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入足量的活性炭和一定量的NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=____________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___________(填“升高”或“降低”),△H______0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_________________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.原电池中电子流出的极为负极,发生氧化反应
B.原电池是将电能转化为化学能的装置
C.原电池中阴离子向正极移动
D.原电池正极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,由于含有Fe2+,现榨的苹果汁会由淡绿色变为棕黄色,在这种苹果汁中加入维生素C,可避免该现象,这些现象体现了( )
A.Fe2+具有酸性,维生素C具有碱性
B.Fe2+具有还原性,维生素C也具有还原性
C.Fe2+具有氧化性,维生素C具有还原性
D.Fe2+具有碱性,维生素C具有酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 所有的分子都是由两个或两个以上的原子构成 B. 所有的三原子分子都是直线形构型
C. 所有的四原子分子都是平面三角形构型 D. 五原子分子不一定是正四面体形构型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.放热反应在任意条件下都能自发进行
B.已知热化学方程式2A(g)+B(g) ![]() 2C (g)△H=-QkJ/mol (Q >0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出QkJ的热量
2C (g)△H=-QkJ/mol (Q >0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出QkJ的热量
C.1mol/L的盐酸与1mol/L的氨水、11mol/L的NaOH溶液等体积混合,充分反应,后者比前者放出的热量多
D.BaCl2溶液中加过量H2SO4 , 溶液中一定不存在Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

(1)试管a中生成乙酸乙酯的化学方程式是________________________________。
(2)试管b中盛放的试剂是饱和_________________溶液。
(3)实验开始时,试管b中的导管不伸入液面下的原因是___________________。
(4)若分离出试管b中生成的乙酸乙酯,需要用到的仪器是______(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.30![]()
![]() 、0.10
、0.10![]()
![]() 和一定量的
和一定量的![]() 三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示[
三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示[![]() 阶段的
阶段的![]() 变化未画出]。乙图为
变化未画出]。乙图为![]() 时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,
时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同, ![]() 阶段为使用催化剂。下列说法不正确的是
阶段为使用催化剂。下列说法不正确的是
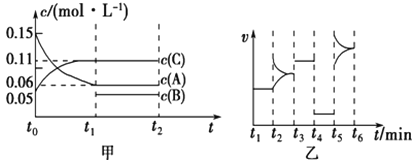
A. 若![]() ,则用
,则用![]() 的浓度变化表示的
的浓度变化表示的![]() 阶段的平均反应速率为0.004
阶段的平均反应速率为0.004![]()
B. ![]() 阶段改变的条件一定为减小压强
阶段改变的条件一定为减小压强
C. 若该容器的容积为2![]() ,则
,则![]() 的起始的物质的量为0.02
的起始的物质的量为0.02![]()
D. 若![]() 阶段,容器内
阶段,容器内![]() 的物质的量减少了0.03
的物质的量减少了0.03![]() ,而此过程中容器与外界的热交换总量为
,而此过程中容器与外界的热交换总量为![]() ,则该反应的热化学方程式为:
,则该反应的热化学方程式为: ![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从溶液中获取固体溶质,常见的方法是蒸发,一般有以下操作过程:①放置蒸发皿;②固定铁圈位置;③放置酒精灯;④停止加热,余热蒸干;⑤加热搅拌。其正确的操作顺序为( )
A.①③②④⑤B.①②③④⑤C.②③①⑤④D.③②①⑤④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com