
【题目】氧化还原反应在生产、生活中具有广泛的用途。下列事例不属于氧化还原反应的是( )
A.金属冶炼B.燃放鞭炮C.食物腐败D.煅烧石灰石
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】C60具有完美的球形结构。之后Si60、N60等球形分子被不断制备出来。回答下列问题:
(1)Si的核外电子排布式为_______,C和N元素中第一电离能较大的是_______。
(2)富勒烯衍生物具有良好的光电性能,富勒烯(C60)的结构如右图所示,C60属于___晶体;C60分子中五元环与六元环的数目比为_____。
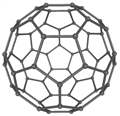
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
(3)N60的晶体中存在的作用力有_____(填字母标号)
A.共价键 B.离子键 C.氢键
D.范德华力 E.配位键 F.金属键
(4)立方氮化硼(BN)可做磨料,其结构与金刚石相似,二者具有相似性结构的原因是_______。
(5)金属M(相对原子质量为m)与N60形成的化合物晶体结构如右图所示(其中白球代表N60,黑球代表金属M),若其晶胞边长为k pm,NA代表阿伏加德罗常数的值,则其密度为______g·cm-3,该化合物中N60的配位数为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在一定条件下反应生成NH3(g),过程如下图,下列说法正确的是
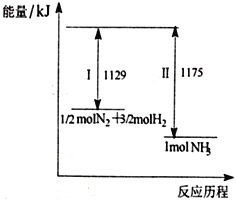
A. I为放热过程、Ⅱ为吸热过程
B. 1/2 molN2和3/2molH2的键能之和大于1 mol NH3的键能
C. 1/2molN2和3/2molH2所具有的能量之和低于1 mol NH3所具有的能量
D. 该过程的热化学反应方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A含有C、H、O三种元素,6.2g完全燃烧后将产物经过浓H2SO4,浓硫酸质量增重5.4g;剩余气体再通过碱石灰被完全吸收,质量增加8.8g。经测定A的相对分子质量为62。(已知两个羟基连在同一个碳上不稳定会自动失去一个水)
(1)试通过计算推断该有机物的分子式_________。
(2)若0.1mol该有机物恰好与4.6g金属钠完全反应,则该有机物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在一个1L的密闭容器中,加入2molA和1 mol B,发生下列反应:
2A(g) + B(g) ![]() 3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
①维持容器的温度不变,若缩小容器的体积,则平衡向(填“正反应方向”、“逆反应方向”或“不”)移动。
②维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2 mol/L的是(填序号);
A.4 mol A+2 mol B
C.2 mol A+1 mol B+3 mol C
B.3 mol C+2molD
③达平衡后若升高温度,B的浓度增加,则正反应的△H(填“>”、“<”或“=”)0。
(2)下图1 mol NO2和1 mol CO反应生成CO2和NO中,CO和NO的浓度随时间变化的示意图。回答下列问题:
①从反应开始到t1时刻,用NO2浓度变化表示平均反应速率v(NO2)=。
②此温度下该反应的平衡常数K=。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法中不正确的是
A. 标准状况下,22.4L C2H4和22.4L苯所含C-H键的数目均为6NA
B. 44g由N2O和CO2组成的混合气体中所含的原子总数为3NA
C. 2.8g由CO和C2H4组成的混合气体中所含的分子总数为0.1NA
D. 1L 0.1mol·L-1CH3COOH溶液中,CH3COOH和CH3COO-的数目之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入足量的活性炭和一定量的NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=____________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___________(填“升高”或“降低”),△H______0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_________________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,由于含有Fe2+,现榨的苹果汁会由淡绿色变为棕黄色,在这种苹果汁中加入维生素C,可避免该现象,这些现象体现了( )
A.Fe2+具有酸性,维生素C具有碱性
B.Fe2+具有还原性,维生素C也具有还原性
C.Fe2+具有氧化性,维生素C具有还原性
D.Fe2+具有碱性,维生素C具有酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com