
����Ŀ����NAΪ�����ӵ���������ֵ������˵���в���ȷ����
A. ��״���£�22.4L C2H4��22.4L������C-H������Ŀ��Ϊ6NA
B. 44g��N2O��CO2��ɵĻ��������������ԭ������Ϊ3NA
C. 2.8g��CO��C2H4��ɵĻ�������������ķ�������Ϊ0.1NA
D. 1L 0.1mol��L-1CH3COOH��Һ�У�CH3COOH��CH3COO-����Ŀ֮��Ϊ0.1NA
���𰸡�A
��������A����ڱ�״���³�Һ̬��������22.4L/mol���㱽�����ʵ���������B�N2O��CO2��Ħ����������44g/mol����44g��N2O��CO2��ɵĻ�������к�����������ʵ���Ϊ![]() =1mol��N2O��CO2������ԭ�ӷ��ӣ���ԭ�����ʵ���Ϊ3mol����ȷ��C�CO��C2H4��Ħ����������28g/mol����2.8g��CO��C2H4��ɵĻ�������к�����������ʵ���Ϊ
=1mol��N2O��CO2������ԭ�ӷ��ӣ���ԭ�����ʵ���Ϊ3mol����ȷ��C�CO��C2H4��Ħ����������28g/mol����2.8g��CO��C2H4��ɵĻ�������к�����������ʵ���Ϊ![]() =0.1mol����ȷ��D�CH3COOH�������ᣬ����Һ�д��ڵ���ƽ�⣺CH3COOH
=0.1mol����ȷ��D�CH3COOH�������ᣬ����Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO-+H+�����������غ�n��CH3COOH��+n��CH3COO-��=0.1mol/L
CH3COO-+H+�����������غ�n��CH3COOH��+n��CH3COO-��=0.1mol/L![]() 1L=0.1mol����ȷ����ѡA��
1L=0.1mol����ȷ����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ����������ȷ���ǣ� ��
A.�����Dz��ȶ��ģ����ú��ײ�������
B.����������Һ�ı��������ǽ����Ǿ�һ���ģ�����Һ�ǻ��ǵ�
C.������ˮ�������˽������ӵ�������
D.�����ȥ�����������е�Ʈ���������˽���Ĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ķ�����һ����ȵ��ǣ� ��
A.�������CO��N2B.������ȡ��ܶȲ��ȵ�N2��CO
C.ԭ����Ŀ��ȵ�O3��N2D.������ȵ�N2��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в���ʹ��ɫ������ɫ�������ǣ� ��
A.����������Һ
B.��ˮ
C.Ư����Һ
D.�Ȼ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�������������о��й㷺����;����������������������ԭ��Ӧ����( )
A.����ұ��B.ȼ�ű���C.ʳ�︯��D.����ʯ��ʯ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC4H10O����������Ʒ�Ӧ�ų��������л����У����������칹���� ��
A.3��
B.4��
C.5��
D.6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ�������У���ȷ���ǣ� ��
A.��20.0gNaOH��ϡ��Һ������ϡ������ȫ�кͣ��ų�28.7kJ�����������ʾ�к��ȵ��Ȼ�ѧ����ʽΪ2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O��l����H=-114.8kJ/mol
B.��֪�Ȼ�ѧ����ʽ��SO2(g)�� ![]() O2(g)
O2(g) ![]() SO3(g) ��H����98.32kJ��mol���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ196.64kJ
SO3(g) ��H����98.32kJ��mol���������г���2molSO2��1molO2��ַ�Ӧ�����շų�������Ϊ196.64kJ
C.��֪2H2(g)��O2(g)��2H2O(g)�� ��H����483.6kJ��mol����H2��ȼ����Ϊ241.8kJ��mol
D.��֪H+(aq)+OH-(aq)=H2O(1) ��H=-57.31kJ��mol-1 �� ��Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)=H2O(1)+BaSO4(s) ��H��-57.31kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֮�乲��һ��̼ԭ�ӵĻ������Ϊ�ݻ��������[2��2]���飨![]() �������һ�֡����й��ڸû������˵���������
�������һ�֡����й��ڸû������˵���������
A. �뻷��ϩ��Ϊͬ���칹��
B. ���ȴ��ﳬ������
C. ����̼ԭ�Ӿ���ͬһƽ��
D. ����1 molC5H12������Ҫ2 molH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������[��CH3COO��2Ni]��һ����Ҫ�Ļ���ԭ�ϡ�һ���Ժ������ϣ���NiS��Al2O3��FeO��CaO��SiO2��Ϊԭ�ϣ���ȡ�������Ĺ�������ͼ���£�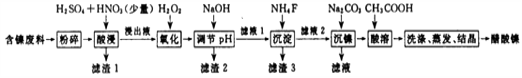
��������������������pH��������ʵ��ܽ������±���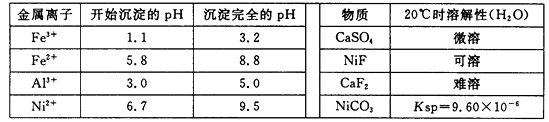
��1������pH�����У���ҺpH�ĵ��ڷ�Χ����
��2������1������3��Ҫ�ɷֵĻ�ѧʽ�ֱ�������
��3����������У�1mol NiSʧȥ6NA�����ӣ�ͬʱ����������ɫ�ж����塣д���÷�Ӧ�Ļ�ѧ����ʽ��
��4������ǰc��Ni2������2.0 mol�� L-1 �� ��ʹ100 mL����Һ�е�Ni2��������ȫ[c��Ni2������10-5mol��L-1]������Ҫ����Na2CO3�������������Ϊg��������С�����1λ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com