
【题目】
(1)在一个1L的密闭容器中,加入2molA和1 mol B,发生下列反应:
2A(g) + B(g) ![]() 3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
①维持容器的温度不变,若缩小容器的体积,则平衡向(填“正反应方向”、“逆反应方向”或“不”)移动。
②维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2 mol/L的是(填序号);
A.4 mol A+2 mol B
C.2 mol A+1 mol B+3 mol C
B.3 mol C+2molD
③达平衡后若升高温度,B的浓度增加,则正反应的△H(填“>”、“<”或“=”)0。
(2)下图1 mol NO2和1 mol CO反应生成CO2和NO中,CO和NO的浓度随时间变化的示意图。回答下列问题:
①从反应开始到t1时刻,用NO2浓度变化表示平均反应速率v(NO2)=。
②此温度下该反应的平衡常数K=。
【答案】
(1)不;C;<
(2)![]() molL-1min-1;9
molL-1min-1;9
【解析】(1)①对于反应前后体积不变的化学反应,压强变化不会引起化学平衡的移动;
②根据等效平衡,把物质都换算成方程式一边的物质,且和初始加入的入2mol A和1mol B相等即可。
A、4molA+2molB 与初始A、B浓度不同,A不符合题意;
B、3molC换算成A、B,A、B的物质的量分别为2mol、1mol,因此容器中4molA+2molB 与初始A、B浓度不同,B不符合题意;
C、D是固体,量的多少不会引起化学平衡的移动,3molC换算成A、B,A、B浓度分别为2mol、1mol,与初始浓度相同,C符合题意;
③达平衡后若升高温度,B的浓度增加,表明平衡向逆反应方向移动,则正反应为放热反应,△H<0;
(2)①由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,故v(NO) = ![]() =
= ![]() molL-1min-1 , 速率之比等于化学计量数之比,故v(NO2)=v(NO)=
molL-1min-1 , 速率之比等于化学计量数之比,故v(NO2)=v(NO)= ![]() molL-1min-1;
molL-1min-1;
②CO的起始浓度为2mol/L,二氧化氮与NO的起始物质的量相等,故NO2的起始浓度为2mol/L,平衡时NO的浓度变化量为1.5mol/L,则:
NO2(g)+ | CO(g) | CO2(g)+ | NO(g) | |
起始(mol/L) | 2 | 2 | 0 | 0 |
转化(mol/L) | 1.5 | 1.5 | 1.5 | 1.5 |
平衡(mol/L) | 0.5 | 0.5 | 1.5 | 1.5 |
故该温度下平衡常数k= ![]() =9;
=9;
故答案为:(1)①不;②C;③<;(2)①![]() molL-1min-1;②9。
molL-1min-1;②9。
(1)①压强对化学平衡移动的影响,应考虑反应前后,气体分子数是否发生改变;
②根据等效平衡进行计算;
③由温度对平衡移动的影响,判断反应的热效应;
(2)①根据反应速率的计算公式![]() 进行计算;
进行计算;
②根据三段式计算平衡常数;


科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 丙烯与氯化氢加成的产物有2种 B. 联二苯![]() 的二氯取代物有15种
的二氯取代物有15种
C. 立方烷![]() 的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年1月11日,中国研制的第四代隐形战机歼-20在成都首次公开试飞成功。隐形战机的核心材料是金属钛,我国探明储量世界第一。下列有关推断不正确的是( )
A. 钛的原子序数为22 B. 钛位于元素周期表第四周期
C. 钛原子核外电子排布式为1s22s22p63s23p63d4 D. 钛属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.硅太阳能电池、计算机芯片、光导纤维都用到硅单质
B.水晶镜片、石英钟表、玛瑙手镯含有SiO2
C.水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐
D.熔融烧碱时不能使用普通玻璃坩埚、石英坩埚和陶瓷坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图a所示(部分产物已略去)。
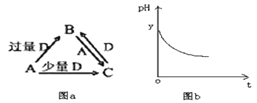
(1)若A为非金属单质,它的组成元素是形成物质种类最多的元素,D是空气的主要成分之一。请写出B的电子式_____________________________________________。
(2)若A为使用最广泛金属的单质,D是某强酸的稀溶液,则反应B+A![]() C的离子方程式为:__________________________________________________。
C的离子方程式为:__________________________________________________。
(3)若A为强碱,D为形成酸雨的气态氧化物。常温时将B的水溶液露置于空气中一段时间,其pH变化如图b所示,则其pH变化的原因是__________________。
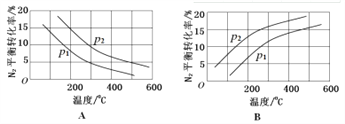
II.(1)对于合成氨反应:N2(g) +3H2(g) ![]() 2NH3(g) △H= -92.4kJ/mol。在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下列图示正确的是_________(填“A”或“B”);比较p1、p2的大小关系:_____________。
2NH3(g) △H= -92.4kJ/mol。在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下列图示正确的是_________(填“A”或“B”);比较p1、p2的大小关系:_____________。
(2)尿素是一种高效化肥,与水在一定条件下可以生成氨气:CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的是___________(填序号)。
2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的是___________(填序号)。
A.在平衡体系中再加入少量CO(NH2)2,平衡正向移动
B.降低温度使尿素的转化率减小
C.从反应开始到达到平衡时容器中混合气体的平均相对分子质量始终保持不变
D.恒温恒容时,向平衡体系中再充入少量氨气,平衡常数减小
(3)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

NH3·H2O的电离常数为_____________________________(已知lg1.8 = 0.26)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A. 在元素周期表的金属和非金属分界线附近寻找半导体材料
B. 漂白粉失效是由于漂白粉中的Ca(ClO)2与空气中的CO2反应生成的HClO见光分解
C. 少量液溴要保存在棕色细口瓶中,并在液溴上面加水封
D. 向煤中加入适量CaCO3,可大大减少燃烧产物中温室气体的排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com