
【题目】下列叙述不正确的是( )
A. 丙烯与氯化氢加成的产物有2种 B. 联二苯![]() 的二氯取代物有15种
的二氯取代物有15种
C. 立方烷![]() 的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
科目:高中化学 来源: 题型:
【题目】短周期的5种主族元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素原子电子层数之和是5;B原子的最外层电子数是其电子层数的2倍;D的一种单质是一种有特殊臭味的淡蓝色气体,可用于杀菌消毒;E与A在同一主族。
请回答下列问题:
(1)A与E可形成化合物甲,甲与水反应可生成H2,写出甲的电子式:__________________。
(2)甲与AlCl3反应得到NaAlH4,甲与NaAlH4都是重要的还原剂,写出NaAlH4与水发生反应的化学方程式:____________________________________。
(3)某同学认为;用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与E的单质反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2;即可证明得到的甲一定是纯净的。判断该同学设想的制备和验纯方法的合理性并说明理由:____________________________________。
(4)C元素的气态氢化物也具有一定的还原性,写出其与CuO反应的化学力程式:____________________________________。
(5)B、D、E组成的一种盐中,B的质量分数为17.91%,其水溶液能使酸性高锰酸钾溶液褪色,写出该盐的化学式:_______________。常温下,该盐的水溶液中离子浓度由大到小的顺序为:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲及其化合物是半导体材料。
(1)25℃时,H2TeO3(亚碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在该温度下,0.1mol·L-1H2TeO3溶液的pH约为_____________(填代号)。
A.0.7 B.1 C.2 D.5
NaHTeO3溶液中,H2TeO3、HTeO3-、TeO32-浓度大小的排序为____________________。
(2)工业上,常用铜阳极泥(主要成分是Cu2Te,含少量的Ag、Au)冶炼碲,其工艺流程如下(已知TeO2微溶于水,易与浓强碱.浓强酸反应):
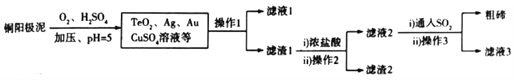
①铜阳极泥溶于硫酸时加压的目的是_____________________________________________;
若调节pH时,pH过低,则粗碲产率会_____________(填“增大”“减小”或“不变”)。
②上述流程中可以循环利用的物质是____________________。
③写出铜阳极泥转化成TeO2的化学方程式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。
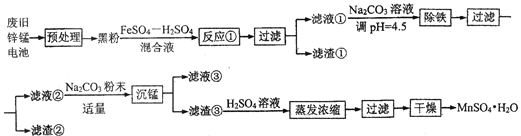
(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是KOH,该电池的负极材料为__________(填化学式),MnO(OH)中Mn的化合价为:________,正极反应式为:__________。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式:______。
(3)MnO2的转化率与温度的关系如下表:
温度/℃ | 20 | 40 | 60 | 80 | 100 |
转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为80℃,其理由是:_______。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO36Mn(OH)25H2O],写出其离子反应方程式:_______,检验沉淀是否洗净的操作是:_______。滤液③中可回收的物质为:________(填化学式)。
(5)“预处理”时,废旧锌锰电池经过拆解、筛分得到炭包,其中含 MnO2为34.8%。称取5.000 g炭包,经处理得到3.211 g MnSO4H2O,计算锰的回收率为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60具有完美的球形结构。之后Si60、N60等球形分子被不断制备出来。回答下列问题:
(1)Si的核外电子排布式为_______,C和N元素中第一电离能较大的是_______。
(2)富勒烯衍生物具有良好的光电性能,富勒烯(C60)的结构如右图所示,C60属于___晶体;C60分子中五元环与六元环的数目比为_____。
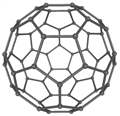
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
(3)N60的晶体中存在的作用力有_____(填字母标号)
A.共价键 B.离子键 C.氢键
D.范德华力 E.配位键 F.金属键
(4)立方氮化硼(BN)可做磨料,其结构与金刚石相似,二者具有相似性结构的原因是_______。
(5)金属M(相对原子质量为m)与N60形成的化合物晶体结构如右图所示(其中白球代表N60,黑球代表金属M),若其晶胞边长为k pm,NA代表阿伏加德罗常数的值,则其密度为______g·cm-3,该化合物中N60的配位数为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度, ![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池反应原理如图所示,下列说法正确的是
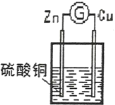
A. 在溶液中,SO42-移向正极 B. 在溶液中,电子从锌片流向铜片
C. 一段时间后,溶液颜色变浅 D. 负极电极反应式为:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在一个1L的密闭容器中,加入2molA和1 mol B,发生下列反应:
2A(g) + B(g) ![]() 3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
①维持容器的温度不变,若缩小容器的体积,则平衡向(填“正反应方向”、“逆反应方向”或“不”)移动。
②维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2 mol/L的是(填序号);
A.4 mol A+2 mol B
C.2 mol A+1 mol B+3 mol C
B.3 mol C+2molD
③达平衡后若升高温度,B的浓度增加,则正反应的△H(填“>”、“<”或“=”)0。
(2)下图1 mol NO2和1 mol CO反应生成CO2和NO中,CO和NO的浓度随时间变化的示意图。回答下列问题:
①从反应开始到t1时刻,用NO2浓度变化表示平均反应速率v(NO2)=。
②此温度下该反应的平衡常数K=。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com