
【题目】下列说法错误的是( )
A.硅太阳能电池、计算机芯片、光导纤维都用到硅单质
B.水晶镜片、石英钟表、玛瑙手镯含有SiO2
C.水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐
D.熔融烧碱时不能使用普通玻璃坩埚、石英坩埚和陶瓷坩埚
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。
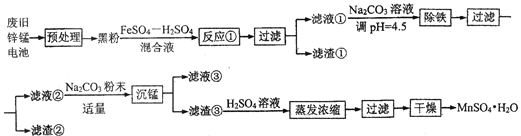
(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是KOH,该电池的负极材料为__________(填化学式),MnO(OH)中Mn的化合价为:________,正极反应式为:__________。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式:______。
(3)MnO2的转化率与温度的关系如下表:
温度/℃ | 20 | 40 | 60 | 80 | 100 |
转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为80℃,其理由是:_______。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO36Mn(OH)25H2O],写出其离子反应方程式:_______,检验沉淀是否洗净的操作是:_______。滤液③中可回收的物质为:________(填化学式)。
(5)“预处理”时,废旧锌锰电池经过拆解、筛分得到炭包,其中含 MnO2为34.8%。称取5.000 g炭包,经处理得到3.211 g MnSO4H2O,计算锰的回收率为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究 , 其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol分枝酸最多可与3 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
(1)图中所示反应是(填“吸热”或“放热”)反应,该反应的△H=(用含E1、E2的代数式表示)。
(2)下列4个反应中符合示意图描述的反应的是____________(填代号)。
A.水蒸气与炭反应
B.用水稀释氢氧化钠溶液
C.铝粉与Fe2O3反应
D.灼热的碳与CO2反应
(3)已知热化学方程式:H2(g)+ ![]() O2 (g)=H2O(g)△H=-241.8kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为。
O2 (g)=H2O(g)△H=-241.8kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为。
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4 (g)+H2O(g)=CO(g)+3H2(g)△H=+206.2 kJ/mo1
CH4(g)+CO2 (g)=2CO(g)+2H2 (g)△ H=+247.4kJ/mo1
CH4 (g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素a、b、c、d、e为前20号主族元素,原子序数依次增大。b元素原子最外层电子数与核外电子总数之比为2:3;c的氢化物能与其最高价氧化物对应的水化物反应生成一种盐;a与b、c均可以形成电子总数为10的分子;d元素的氧化物能使品红溶液褪色,且加热后品红颜色复原;e原子是前20号主族元素中原子半径最大的。请回答:
(1)e元素在周期表中的位置_______________。
(2)bd2的电子式_______________;e2d的电子式_______________;ca3的空间构型_______________。
(3)e的最高价氧化物的水化物所含化学键类型为______________、_______________,晶体类型为_______________。其溶液与b的最高价氧化物反应的离子方程式为____________________________。
(4)在常温常压下,1g b的最简单气态氢化物完全燃烧放出的热量约为56kJ,写出该反应的热化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在一个1L的密闭容器中,加入2molA和1 mol B,发生下列反应:
2A(g) + B(g) ![]() 3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
①维持容器的温度不变,若缩小容器的体积,则平衡向(填“正反应方向”、“逆反应方向”或“不”)移动。
②维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2 mol/L的是(填序号);
A.4 mol A+2 mol B
C.2 mol A+1 mol B+3 mol C
B.3 mol C+2molD
③达平衡后若升高温度,B的浓度增加,则正反应的△H(填“>”、“<”或“=”)0。
(2)下图1 mol NO2和1 mol CO反应生成CO2和NO中,CO和NO的浓度随时间变化的示意图。回答下列问题:
①从反应开始到t1时刻,用NO2浓度变化表示平均反应速率v(NO2)=。
②此温度下该反应的平衡常数K=。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)乙酸乙酯用途广泛,在食品中可作为香料原料,现利用如下方法制备和提纯。
Ⅰ、制备
在试管a中先加入3mLCH3CH2OH,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mLCH3CO18OH,充分混合后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止加热。

(1)该装置有一处错误,请指出__________________________。
(2)试管a中生成乙酸乙酯的化学方程式(标记出18O的位置)______________________________。
(3)加入浓H2SO4的作用是______________________________。
II、提纯:

(1)操作1需用到_____________(填仪器名称),上层液体从该仪器的_________分离出来(填“上口”或“下口”)。
(2)请根据乙酸乙酯的性质选择合适的干燥剂__________。
a.氯化钙 b.碱石灰 c.硫酸铜
(3)试管b中混合液体在振荡过程中有气泡产生,该反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子构型为正四面体的是( )
①P4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
A.①③④⑤ B.①③④⑤⑥ C.①③④ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题(用对应元素的元素符号作答):
(1)写出D元素基态原子的价电子排布式 , E2+价电子的轨道表示式。
(2)这5种元素中电负性最大的元素是(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com