
����Ŀ���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ�����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӳ�Ϊ����ӣ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ����kJ/mol��ʾ��������۲���ͼ��Ȼ��ش����⣺
��1��ͼ����ʾ��Ӧ��(����ȡ����ȡ�)��Ӧ���÷�Ӧ�ġ�H=(�ú�E1��E2�Ĵ���ʽ��ʾ)��
��2������4����Ӧ�з���ʾ��ͼ�����ķ�Ӧ����____________(�����)��
A.ˮ������̿��Ӧ
B.��ˮϡ������������Һ
C.������Fe2O3��Ӧ
D.���ȵ�̼��CO2��Ӧ
��3����֪�Ȼ�ѧ����ʽ��H2(g)+ ![]() O2 (g)=H2O(g)��H=-241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2 kJ/mol�������淴Ӧ�Ļ��Ϊ��
O2 (g)=H2O(g)��H=-241.8kJ/mol���÷�Ӧ�Ļ��Ϊ167.2 kJ/mol�������淴Ӧ�Ļ��Ϊ��
��4���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ������֪��
CH4 (g)+H2O(g)=CO(g)+3H2(g)��H=+206.2 kJ/mo1
CH4(g)+CO2 (g)=2CO(g)+2H2 (g)�� H=+247��4kJ/mo1
CH4 (g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ��
���𰸡�
��1�����ȣ�(E2-E1)kJ/mol
��2��C
��3��409.0KJ/mol
��4��CH4(g)+2H2O(g)�TCO2(g)+4H2(g)��H=165.0kJ/mo1
����������1������ͼ�������Ӧ��������������������������Ӧ���ȣ���Ӧ���ʱ�=�����������-��Ӧ�������������H=(E2-E1)kJ/mo1��
��2��A��ˮ������̿��Ӧ�������ȷ�Ӧ��A���������⣻
B����ˮϡ������������Һ�����ڻ�ѧ��Ӧ��B���������⣻
C��������Fe2O3��Ӧ�ķ�Ӧ���ڷ��ȷ�Ӧ��C�������⣻
D�����ȵ�̼��CO2��Ӧ�������ȷ�Ӧ��D���������⣻
��3����Ӧ�Ļ����ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ�����������ͼ��������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��+��Ӧ���ʱ䣻H2(g)+ ![]() O2(g)�TH2O(g)��H=-241.8kJ/mo1���÷�Ӧ�Ļ��Ϊ167.2kJ/mol�������淴Ӧ�Ļ��=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol��
O2(g)�TH2O(g)��H=-241.8kJ/mo1���÷�Ӧ�Ļ��Ϊ167.2kJ/mol�������淴Ӧ�Ļ��=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol��
��4����CH4(g)+H2O(g)�TCO(g)+3H2(g)��H=206.2kJ/mol��
��CH4(g)+CO2(g)�T2CO(g)+2H2(g)��H=247.4kJ/mol���ݸ�˹���ɣ��١�2-�ڵã�CH4(g)+2H2O(g)�TCO2(g)+4H2(g)��H=165.0kJ/mol��
���Դ��ǣ���1�����ȣ�(E2-E1)kJ/mol����2��C����3��409.0KJ/mol����4��CH4(g)+2H2O(g)�TCO2(g)+4H2(g)��H=165.0kJ/mol
�����㾫�����������⣬������Ҫ�˽ⷴӦ�Ⱥ��ʱ�(�ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ��)��


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ŀǰ����Ԫ�����ڱ���˵������ȷ���ǣ� ��
A.�ڢ�B��Ԫ���������
B.ֻ�е�3�е���12��ȫ���ǽ���Ԫ��
C.���������ڻ�����������ʱ��һ���ǽ���Ԫ��
D.�ǰ�ԭ�ӵ���������С�����˳����Ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��39��Ԫ���Ƶĵ����Ų�ʽӦ�������Ų��е���һ��( )
A. 1s22s22p63s23p63d104s24p64d15s2
B. 1s22s22p63s23p63d104s24p65s25p1
C. 1s22s22p63s23p63d104s24p64f15s2
D. 1s22s22p63s23p63d104s24p65s25d1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һƿǩ��ע��Ϊ���������Σ��ơ�þ���ơ������ĸ����Ƽ���ijͬѧΪ��ȷ����ɷ֣�ȡ�����Ƽ���Ϊ��Һ����Ʋ����������ʵ�飺

��֪��������ҺpH��4ʱ��Fe(OH)3������ȫ��Ca2����Mg2����������
��ͬѧ�ó��Ľ�����ȷ����
A. ��������1���Ƴ�����Һ�к���Na��
B. ��������2���Ƴ�����Һ�в����������������
C. ��������3��4���Ƴ�����Һ�к���Ca2������û��Mg2��
D. ��������5���Ƴ�����Һ��һ������Fe2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2011��1��11�գ��й����Ƶĵ��Ĵ�����ս���ߣ�20�ڳɶ��״ι����Էɳɹ�������ս���ĺ��IJ����ǽ����ѣ��ҹ�̽�����������һ�������й��ƶϲ���ȷ����(����)
A. �ѵ�ԭ������Ϊ22 B. ��λ��Ԫ�����ڱ���������
C. ��ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d4 D. �����ڹ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ǣ� ��
A.��̫���ܵ�ء������оƬ�����ά���õ��赥��
B.ˮ����Ƭ��ʯӢ�ӱ��������������SiO2
C.ˮ��·�š��Ŵ�������ש�ߡ��մɲ;����ò���Ϊ������
D.�����ռ�ʱ����ʹ����ͨ����������ʯӢ�������մ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��A��B��C��D��Ϊ��ѧ��ѧ�г����ĵ��ʻ������֮��Ĺ�ϵ��ͼa��ʾ�����ֲ�������ȥ����
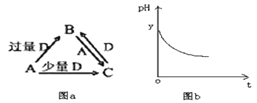
��1����AΪ�ǽ������ʣ��������Ԫ�����γ�������������Ԫ�أ�D�ǿ�������Ҫ�ɷ�֮һ����д��B�ĵ���ʽ_____________________________________________��
��2����AΪʹ����㷺�����ĵ��ʣ�D��ijǿ���ϡ��Һ����ӦB+A![]() C�����ӷ���ʽΪ��__________________________________________________��
C�����ӷ���ʽΪ��__________________________________________________��
��3����AΪǿ�DΪ�γ��������̬���������ʱ��B��ˮ��Һ¶���ڿ�����һ��ʱ�䣬��pH�仯��ͼb��ʾ������pH�仯��ԭ����__________________��
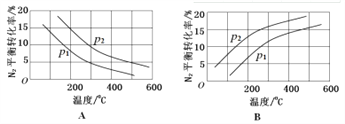
II����1�����ںϳɰ���Ӧ��N2(g) +3H2(g) ![]() 2NH3(g) ��H= ��92.4kJ/mol��������������ͬʱ���ֱ�ⶨN2��ƽ��ת�����ڲ�ͬѹǿ��p1��p2)�����¶ȱ仯�����ߣ�����ͼʾ��ȷ����_________(�A����B�������Ƚ�p1��p2�Ĵ�С��ϵ��_____________��
2NH3(g) ��H= ��92.4kJ/mol��������������ͬʱ���ֱ�ⶨN2��ƽ��ת�����ڲ�ͬѹǿ��p1��p2)�����¶ȱ仯�����ߣ�����ͼʾ��ȷ����_________(�A����B�������Ƚ�p1��p2�Ĵ�С��ϵ��_____________��
��2��������һ�ָ�Ч���ʣ���ˮ��һ�������¿������ɰ�����CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) ��H = +133.6kJ/mol�����ڸ÷�Ӧ������˵����ȷ����___________(����ţ���
2NH3(g)+CO2(g) ��H = +133.6kJ/mol�����ڸ÷�Ӧ������˵����ȷ����___________(����ţ���
A����ƽ����ϵ���ټ�������CO(NH2)2��ƽ�������ƶ�
B�������¶�ʹ���ص�ת���ʼ�С
C���ӷ�Ӧ��ʼ���ﵽƽ��ʱ�����л�������ƽ����Է�������ʼ�ձ��ֲ���
D�����º���ʱ����ƽ����ϵ���ٳ�������������ƽ�ⳣ����С
��3����������100mL0.2mo/L�İ�ˮ����μ���0.2mol/L�����ᣬ������Һ��pH����Һ��NH4+��NH3��H2O���ʵ���������������������Ĺ�ϵ����ͼ��ʾ,����ͼ��ش��������⡣

NH3��H2O�ĵ��볣��Ϊ_____________________________(��֪lg1.8 = 0.26)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I������������ת������A��һ�����Σ�D����Է���������C����Է���������16��E��������X������ǿ�ỹ��ǿ��ʱ���������µ�ת����ϵ��
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
��X��ǿ��ʱ��A��B��C��D��E����ͬһ��Ԫ�أ���X��ǿ��ʱ��A��B��C��D��E���������ͬһ��Ԫ�ء���ش��������⣺
��1��A�Ļ�ѧʽ��__________�� Y�Ľṹʽ��___________��Z�������еĵĻ�ѧ��_________
��2����X��ǿ��ʱ��д��E��ϡ��Һ��ͭ��Ӧ����C�����ӷ���ʽ��_____________________��
II��dz��ɫ����������茶���[����Ī���Σ���NH4��2SO4FeSO46H2O]���̷���FeSO47H2O�����ȶ��������ڶ���������Ī���ε�һ��ʵ�����Ʒ����£�
����м![]()
![]() ��ҺA
��ҺA![]()
![]()
![]() Ī����
Ī����
��1�������м�м���ϡ���������м��ȫ�ܽ����ʣ������ʱ�ͽ��й��ˣ���Ŀ����_______��
��2��Ũ�Ⱦ�Ϊ0.10molL��1��Ī������Һ��FeSO4��Һ��c��Fe2+��ǰ��__����.����������������С���������������������ж�����
��3��������װ����ѡȡ��Ҫ��װ����ȡ��NH4��2SO4��Һ�����ӵ�˳���ýӿ������ĸ��ʾ���ǣ�a��������������������________

��4�������£���0.10molL��1��NH4��2SO4��Һ��pH=5������NH3H2O�ĵ���ƽ�ⳣ��Kb��______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com