
【题目】关于目前常用元素周期表的说法中正确的是( )
A.第ⅢB族元素种类最多
B.只有第3列到第12列全部是金属元素
C.周期数大于或等于族的序数时,一定是金属元素
D.是按原子的质量数由小到大的顺序编制的
科目:高中化学 来源: 题型:
【题目】A是一种常见的有机物,其产量可以作为衡量一个国家石油化工发展水平的标志,F是高分子化合物,有机物A可以实现如下转换关系。请回答下列问题:
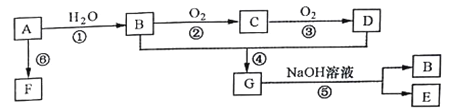
(1)A的结构式为________。
(2)D中含氧原子团的名称为_____,④的化学反应类型为_______。
(3)请分别写出⑤、⑥的化学方程式__________、_________。
(4)在实验室中,可用下图所示装置制取少量G,试管a中盛放的试剂是____,其作用为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲及其化合物是半导体材料。
(1)25℃时,H2TeO3(亚碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在该温度下,0.1mol·L-1H2TeO3溶液的pH约为_____________(填代号)。
A.0.7 B.1 C.2 D.5
NaHTeO3溶液中,H2TeO3、HTeO3-、TeO32-浓度大小的排序为____________________。
(2)工业上,常用铜阳极泥(主要成分是Cu2Te,含少量的Ag、Au)冶炼碲,其工艺流程如下(已知TeO2微溶于水,易与浓强碱.浓强酸反应):
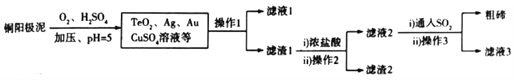
①铜阳极泥溶于硫酸时加压的目的是_____________________________________________;
若调节pH时,pH过低,则粗碲产率会_____________(填“增大”“减小”或“不变”)。
②上述流程中可以循环利用的物质是____________________。
③写出铜阳极泥转化成TeO2的化学方程式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+ B2(g) ![]() 2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )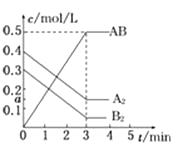
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。
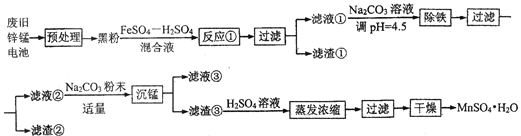
(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是KOH,该电池的负极材料为__________(填化学式),MnO(OH)中Mn的化合价为:________,正极反应式为:__________。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式:______。
(3)MnO2的转化率与温度的关系如下表:
温度/℃ | 20 | 40 | 60 | 80 | 100 |
转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为80℃,其理由是:_______。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO36Mn(OH)25H2O],写出其离子反应方程式:_______,检验沉淀是否洗净的操作是:_______。滤液③中可回收的物质为:________(填化学式)。
(5)“预处理”时,废旧锌锰电池经过拆解、筛分得到炭包,其中含 MnO2为34.8%。称取5.000 g炭包,经处理得到3.211 g MnSO4H2O,计算锰的回收率为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度, ![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
(1)图中所示反应是(填“吸热”或“放热”)反应,该反应的△H=(用含E1、E2的代数式表示)。
(2)下列4个反应中符合示意图描述的反应的是____________(填代号)。
A.水蒸气与炭反应
B.用水稀释氢氧化钠溶液
C.铝粉与Fe2O3反应
D.灼热的碳与CO2反应
(3)已知热化学方程式:H2(g)+ ![]() O2 (g)=H2O(g)△H=-241.8kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为。
O2 (g)=H2O(g)△H=-241.8kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为。
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4 (g)+H2O(g)=CO(g)+3H2(g)△H=+206.2 kJ/mo1
CH4(g)+CO2 (g)=2CO(g)+2H2 (g)△ H=+247.4kJ/mo1
CH4 (g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com