
【题目】39号元素钇的电子排布式应是下列排布中的哪一组( )
A. 1s22s22p63s23p63d104s24p64d15s2
B. 1s22s22p63s23p63d104s24p65s25p1
C. 1s22s22p63s23p63d104s24p64f15s2
D. 1s22s22p63s23p63d104s24p65s25d1
科目:高中化学 来源: 题型:
【题目】A是一种常见的有机物,其产量可以作为衡量一个国家石油化工发展水平的标志,F是高分子化合物,有机物A可以实现如下转换关系。请回答下列问题:
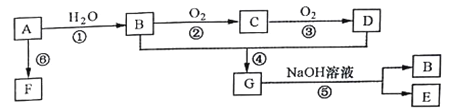
(1)A的结构式为________。
(2)D中含氧原子团的名称为_____,④的化学反应类型为_______。
(3)请分别写出⑤、⑥的化学方程式__________、_________。
(4)在实验室中,可用下图所示装置制取少量G,试管a中盛放的试剂是____,其作用为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。
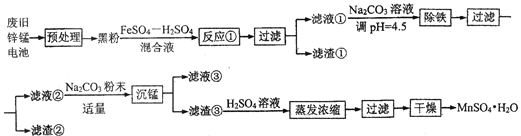
(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是KOH,该电池的负极材料为__________(填化学式),MnO(OH)中Mn的化合价为:________,正极反应式为:__________。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式:______。
(3)MnO2的转化率与温度的关系如下表:
温度/℃ | 20 | 40 | 60 | 80 | 100 |
转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为80℃,其理由是:_______。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO36Mn(OH)25H2O],写出其离子反应方程式:_______,检验沉淀是否洗净的操作是:_______。滤液③中可回收的物质为:________(填化学式)。
(5)“预处理”时,废旧锌锰电池经过拆解、筛分得到炭包,其中含 MnO2为34.8%。称取5.000 g炭包,经处理得到3.211 g MnSO4H2O,计算锰的回收率为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH均为2、体积均为V0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随lg![]() 的变化关系如图所示,下列叙述错误的是
的变化关系如图所示,下列叙述错误的是

A. 常温下:Ka(HB)>Ka(HC)
B. HC的电离度:a点<b点
C. 当lg![]() =4时,三种溶液同时升高温度,
=4时,三种溶液同时升高温度, ![]() 减小
减小
D. 当lg![]() =5时,HA溶液的pH为7
=5时,HA溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下图转化关系,试推断回答下列问题。
(1)D元素原子的结构示意图为;
(2)A、B、C三种元素的原子半径由小到大的顺序为(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为;
(4)A的气态氢化物的电子式 ;
(5)实验室中,制取A的气态氢化物的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池反应原理如图所示,下列说法正确的是
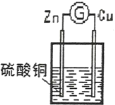
A. 在溶液中,SO42-移向正极 B. 在溶液中,电子从锌片流向铜片
C. 一段时间后,溶液颜色变浅 D. 负极电极反应式为:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究 , 其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol分枝酸最多可与3 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
(1)图中所示反应是(填“吸热”或“放热”)反应,该反应的△H=(用含E1、E2的代数式表示)。
(2)下列4个反应中符合示意图描述的反应的是____________(填代号)。
A.水蒸气与炭反应
B.用水稀释氢氧化钠溶液
C.铝粉与Fe2O3反应
D.灼热的碳与CO2反应
(3)已知热化学方程式:H2(g)+ ![]() O2 (g)=H2O(g)△H=-241.8kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为。
O2 (g)=H2O(g)△H=-241.8kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为。
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4 (g)+H2O(g)=CO(g)+3H2(g)△H=+206.2 kJ/mo1
CH4(g)+CO2 (g)=2CO(g)+2H2 (g)△ H=+247.4kJ/mo1
CH4 (g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子构型为正四面体的是( )
①P4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
A.①③④⑤ B.①③④⑤⑥ C.①③④ D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com