
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题(用对应元素的元素符号作答):
(1)写出D元素基态原子的价电子排布式 , E2+价电子的轨道表示式。
(2)这5种元素中电负性最大的元素是(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式。
【答案】
(1)3s23p1;![]()
(2)O;N>O>C
(3)N3->O2->Al3+
(4)![]()
【解析】(1)Al元素的原子序数是13,其基态原子的价电子排布式为3s23p1 , Fe2+价电子的轨道表示式为 ![]() 。
。
(2)非金属性越强,电负性越大,则这5种元素中电负性最大的元素是O;非金属性越强,第一电离能越大,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,则A、B、C三种元素的第一电离能由大到小的顺序为N>O>C。
(3)核外电子排布相同的离子,其离子半径随原子序数的增大而减小,则B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+。
(4)氧元素的核外有18个电子的氢化物是双氧水,属于共价化合物,电子式为 ![]() 。 A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,由A的基态原子的价电子排布式可知,n=2,则A为C元素;C的最外层电子数是电子层数的3倍,则C为O元素;B的基态原子中的未成对电子数是同周期中最多的,可知p能级上只有3个电子,结合原子序数可知,B为N元素;D为简单离子是第三周期元素中离子半径最小的,则D为Al元素;E的价电子层中的未成对电子数为4,则E为Fe,电子排布式为[Ar]3d64s2 , 以此来解答.
。 A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,由A的基态原子的价电子排布式可知,n=2,则A为C元素;C的最外层电子数是电子层数的3倍,则C为O元素;B的基态原子中的未成对电子数是同周期中最多的,可知p能级上只有3个电子,结合原子序数可知,B为N元素;D为简单离子是第三周期元素中离子半径最小的,则D为Al元素;E的价电子层中的未成对电子数为4,则E为Fe,电子排布式为[Ar]3d64s2 , 以此来解答.


科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.硅太阳能电池、计算机芯片、光导纤维都用到硅单质
B.水晶镜片、石英钟表、玛瑙手镯含有SiO2
C.水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐
D.熔融烧碱时不能使用普通玻璃坩埚、石英坩埚和陶瓷坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
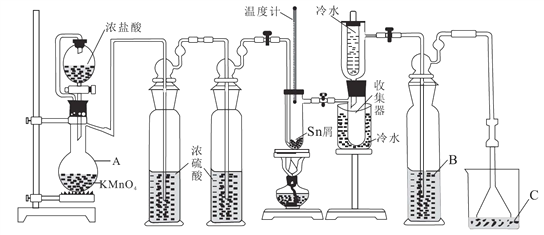
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______,其中发生反应的离子方程式是____________。
(2)点燃酒精灯前需排尽装置中的空气,否则会发生副反应,化学方程式是______、_____。
(3)试剂 B、C依次为_______,试剂B的作用是______。
(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是_______、_______。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉-KI溶液做指示剂,用c mol·L-1 碘标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量_______(用含c、m、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外的同一种元素。请回答下列问题:
(1)A的化学式是__________, Y的结构式是___________,Z中所含有的的化学键_________
(2)当X是强碱时,写出E的稀溶液和铜反应生成C的离子方程式:_____________________。
II、浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4FeSO46H2O]比绿矾(FeSO47H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
废铁屑![]()
![]() 溶液A
溶液A![]()
![]()
![]() 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是_______.
(2)浓度均为0.10molL﹣1的莫尔盐溶液和FeSO4溶液,c(Fe2+)前者__后者.(填“大于”、“小于”或“等于”或“无法判断”)
(3)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接 ; 接 .________

(4)常温下,若0.10molL﹣1(NH4)2SO4溶液的pH=5,求算NH3H2O的电离平衡常数Kb≈______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴含量约为 65 mg·L-1,从海水中提取溴的工艺流程如下:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____________。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的____。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:_____![]()
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是____。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A. 在元素周期表的金属和非金属分界线附近寻找半导体材料
B. 漂白粉失效是由于漂白粉中的Ca(ClO)2与空气中的CO2反应生成的HClO见光分解
C. 少量液溴要保存在棕色细口瓶中,并在液溴上面加水封
D. 向煤中加入适量CaCO3,可大大减少燃烧产物中温室气体的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是一个电化学过程的示意图。
请回答下列问题:
(1)写出通入CH3OH的电极的电极反应式。
(2)乙池中反应的化学方程式为 , 当乙池中B极质量增加5.4g,甲池中理论上消耗O2的体积为L(标准状况下),此时丙池中析出1.6g某金属,则丙池中的某盐溶液可能是(填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
Ⅱ.NO2 可通过点解制备绿色硝化试剂N2O5。下图是其原理示意图。
阳极区生成N2O5的电极反应式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)及其化合物被广泛应用在除草剂、杀虫剂以及含砷药物中。已知砷元素位于周期表中的第四周期第ⅤA族。
(1)As元素最低价态对应的氢化物M的化学式是________。
①请任选另一种氢化物比较它与M的热稳定性(均用化学式表达)__________。
②M具有极强的还原性,可与AgNO3溶液反应产生黑色的Ag和As2O3,该反应可以用来检验微量砷,该反应的化学方程式是____________。
(2)As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子方程式:_____。
(3)As2S3和HNO3反应如下:As2S3+10H++10N![]() ==2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在__(填“正极”或“负极”)附近逸出,该极的电极反应式是__。
==2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在__(填“正极”或“负极”)附近逸出,该极的电极反应式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)c2(OH-)=2×10-20mol2L-2 .
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于;
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com