
����Ŀ��������һ����Ҫ�Ļ���ԭ�Ϻ������Դ���о���������������������Ҫ���塣
��ش�
��1����֪һ�������·������·�Ӧ��CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) ��H=+802kJ��mol��1����һ������CO2(g)��H2O(g)����10L�ܱ������У��ֱ��ڴ���M��N�������·���������Ӧ��CH4(g)�IJ���(n)�����ʱ��(t)���¶�(T)�仯�Ĺ�ϵ��ͼ1��ʾ��
CH4(g)+2O2(g) ��H=+802kJ��mol��1����һ������CO2(g)��H2O(g)����10L�ܱ������У��ֱ��ڴ���M��N�������·���������Ӧ��CH4(g)�IJ���(n)�����ʱ��(t)���¶�(T)�仯�Ĺ�ϵ��ͼ1��ʾ��
���������ȼ����(��H)Ϊ��890kJ��mol��1����ˮ����������H=___________��(������ָ1molҺ��ת��Ϊ����ʱ���յ�����)
��T1��������M�����£�0~20h�ڸ÷�Ӧ����v(H2O)=___________���÷�Ӧ��ƽ�ⳣ������ʽK=___________
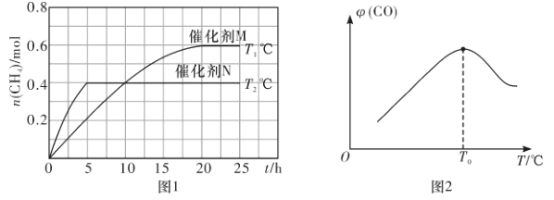
�۸���ͼ1�жϣ�T1___________T2(������������������=��)������Ϊ___________��
�����Ĵ�Ч����M___________N(����ǿ��������������)��
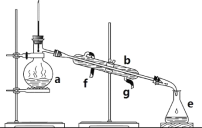
��2������������Ʊ��ϳ�����CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H����CH4(g)��H2O(g)�����ʵ���֮��Ϊ1��3����ʢ�д����ĸ��������з����÷�Ӧ����ͬʱ����ڲ��CO���������(
CO(g)+3H2(g) ��H����CH4(g)��H2O(g)�����ʵ���֮��Ϊ1��3����ʢ�д����ĸ��������з����÷�Ӧ����ͬʱ����ڲ��CO���������(![]() )���¶�(T)�Ĺ�ϵ��ͼ2��ʾ��T0��ʱ��CO�������������ԭ��Ϊ_________________________________���÷�Ӧ����H_______0(��������������)
)���¶�(T)�Ĺ�ϵ��ͼ2��ʾ��T0��ʱ��CO�������������ԭ��Ϊ_________________________________���÷�Ӧ����H_______0(��������������)
���𰸡�+44 kJmol��1 0.006 molL��1h��1 K=![]() > �÷�ӦΪ���ȷ�Ӧ���¶����ߣ�CH4�IJ������� ���� ����T0 ��ʱ����ͬʱ������¶�Խ�߷�Ӧ����Խ�죬CO���������Խ����T0 ��ʱ����Ӧ�ﵽƽ�⣬�÷�ӦΪ���ȷ�Ӧ���¶�Խ��CO���������ԽС (�𰸺�������) ��
> �÷�ӦΪ���ȷ�Ӧ���¶����ߣ�CH4�IJ������� ���� ����T0 ��ʱ����ͬʱ������¶�Խ�߷�Ӧ����Խ�죬CO���������Խ����T0 ��ʱ����Ӧ�ﵽƽ�⣬�÷�ӦΪ���ȷ�Ӧ���¶�Խ��CO���������ԽС (�𰸺�������) ��
��������
��1�����������ȼ����(��H)Ϊ-890kJ��mol-1����CH4(g)+O2(g)===CO2(g)+2H2O(l) ��H= - 890kJ/mol��
��v(H2O)=![]() ��ƽ�ⳣ����������Ũ��ϵ���η��ij˻��뷴Ӧ��Ũ��ϵ���η��˻��ıȣ�
��ƽ�ⳣ����������Ũ��ϵ���η��ij˻��뷴Ӧ��Ũ��ϵ���η��˻��ıȣ�
�۴�����ƽ���ƶ���Ӱ�죬����Ӧ���ȣ������¶�ƽ�������ƶ�����������ʵ�������
����Ӱ�췴Ӧ���ʣ�
��2���¶�Խ�ߣ���Ӧ����Խ�죬CO�������������T0����¶�����CO�����������С��˵��ƽ�������ƶ���
��1�����������ȼ����(��H)Ϊ-890kJ��mol-1����CH4(g)+O2(g)===CO2(g)+2H2O(l) ��H= -890kJ/mol����CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) ��H= +802kJ��mol-1�����ݸ�˹���� �٣��ڵ�2H2O(g)=2H2O(l) ��H= -88kJ/mol��ˮ����������H= +44 kJmol-1��
CH4(g)+2O2(g) ��H= +802kJ��mol-1�����ݸ�˹���� �٣��ڵ�2H2O(g)=2H2O(l) ��H= -88kJ/mol��ˮ����������H= +44 kJmol-1��
��T1�桢����M�����£�0~20h�����ɼ���0.6mol��������ˮ1.2mol���÷�Ӧ����v(H2O)= ![]() =
=![]() =0.006 molL-1h-1���÷�Ӧ��ƽ�ⳣ������ʽK=
=0.006 molL-1h-1���÷�Ӧ��ƽ�ⳣ������ʽK=![]() ��
��
�۴�����ƽ���ƶ���Ӱ�죬����Ӧ���ȣ������¶�ƽ�������ƶ�����������ʵ�������ƽ��ʱ��������ʵ���M����N������T1��T2��T1��T2����M������С��N�����Դ����Ĵ�Ч����M����N��
(2). ����T0 ��ʱ����ͬʱ������¶�Խ�߷�Ӧ����Խ�죬CO���������Խ����T0 ��ʱ����Ӧ�ﵽƽ�⣬�¶�Խ��CO���������ԽС������T0��ʱ��CO�������������¶�Խ��CO���������ԽС��˵������Ӧ���ȣ���H��0��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������������������Ʒ����5mol��L��1������140mLǡ����ȫ�ܽ⣬������Һ�������ձ����0.56��������ǡ��ʹ����Fe2��ȫ��ת����Fe3��������Ʒ���ܵĻ�ѧʽ�ǣ� ��
A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����aL������狀�����淋Ļ��Һ�ֳ����ȷݣ�һ������b mol�ռ�պð�笠�����ȫ���ϳ�����һ�����Ȼ�����Һ��Ӧʱ������c mol�Ȼ������ɴ˿�֪ԭ��Һ��NO3�������ʵ���Ũ���ǣ���λ��mol��L��1�� ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�á�
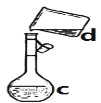
��1��д���������������ƣ�a.____________��b.___________��
��2��������װ�÷������Ȼ�̼�;ƾ��Ļ�����ȱ�ٵ�������__________���������������������ʵ�飬�¶ȼ�ˮ�����λ����______����
��.����һ�����ʵ���Ũ�ȵ���Һ�ǻ�ѧʵ���ҵĻ���ʵ�����֮һ����ش��������⣺
��3������0.5 mol/L��������Һ450 mL��������Ͳ��ȡ��������98%���ܶ�1.84 g/cm3��Ũ��������Ϊ_____mL�����ʵ������15 mL��20 mL��50 mL ��Ͳ��Ӧ���ѡ��_____mL��Ͳ��
��4������������Һ�����õ���Ͳ���ձ����������⣬����Ҫ�����ֲ���������_____��_______��
��5������ʱ������ȷ�IJ���˳����__________������ĸ��ʾ��ÿ������ֻ��һ�Σ���
A��������ˮϴ���ձ�2�Ρ�3�Σ�ϴ��Һ��ע������ƿ����
B����ʢ��ˮ���ձ��м���Ũ����ϡ��
C�����ձ�������ȴ����Һ�ز�����ע������ƿ��
D��������ƿ�ǽ����������µߵ���ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1 cm��2 cm��
��6�������������������������ҺŨ�Ƚ��к�Ӱ�죨�ƫ�ߡ�����ƫ�͡�����Ӱ�족������û�н���A����___________��������ʱ���ӿ̶���_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������NaOH��������1.0 mol��L-1��NaOH��Һ240 mL��������������ȷ���ǣ� ��

A.ijͬѧ������һ������NaOH���壬������������ƽ�����ձ�����������ƽƽ����״̬��ͼ�����ձ���ʵ������Ϊ27.4 g
B.Ҫ��ɱ�ʵ���ͬѧӦ�Ƴ�10.0g NaOH
C.�������ƹ����ܽ�����ָ��������ٽ���ת��
D.����ƿʹ��ǰ��ϴ�ӡ������ָ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص绯ѧװ�õ�˵����ȷ����
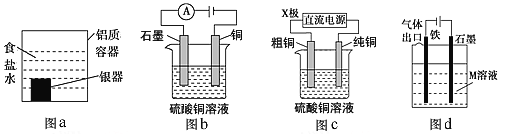
A. ����ͼaװ�ô�����������ĺڰ�Ag2S����������ķ�ӦΪAg2S��2e��=2Ag��S2��
B. ͼb���һ��ʱ�䣬ͭ�缫�ܽ⣬ʯī�缫��������ɫ��������
C. ͼc�е�X����Ϊ���������װ�ÿ�ʵ�ִ�ͭ�ľ���
D. ͼd����M�Ǻ�ˮ����װ����ͨ��������������������������ʹ��������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ƶõĵ�����(AlN)��Ʒ�г���������Al4C3��Al2O3��C�����ʡ�ijͬѧ�������ʵ��ֱ�ⶨ������(AlN��Ʒ��AlN��Al4C3����������(����NH3��ǿ������Һ�е��ܽ�)��
��1��ʵ��ԭ������Al4C3�����ᷴӦ������CH4��
��AlN����ǿ�������Σ�����ǿ�����ɰ�������д��AlN��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��____________��
��2��ʵ��װ��(��ͼ��ʾ��������Ϊ��ʽ�ζ��ܸ�װ)
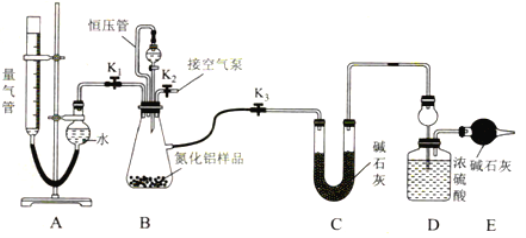
����װ�ú�����Ӧ���еIJ�����________��
��3��ʵ����̣��Ƶ�װ��D�ij�ʼ����Ϊy g����ȡx g AlN��Ʒ����װ��B��ƿ�У���װ���м�����ӦҩƷ����������װ�ã���ȡ�����ܵij�ʼ����Ϊa mL(����װ������Һ����ƽ)��
�������Ȳ���Al4C3�����������й����ݣ������������IJ�����________��
������ѹ�ܣ����������������Ӱ����________(�ƫ��ƫС������Ӱ�족)
����������Һ�治�ٷ����仯��˵����Ӧ�Ѿ���������ȡ����֮ǰ��Ӧ�������ܽ��е��������ܸ߶ȣ�ʹ��������Һ����ƽ �����������е�Һ������Ҳ����������е�Һ�棬������������______(�ƫ��ƫС������Ӱ�족)��
�ܼ�¼�ζ��ܵĶ���Ϊb mL(��֪����ʵ�������µ�����Ħ�����ΪVm L��mol��1)����Al4C3����������Ϊ______(�ú�a��b��x��y��Vm�Ĵ���ʽ��ʾ)��
�ݲ���AlN�������������ݣ����ȹرջ��� K1 ������K3��ͨ����Һ©���������___����װ��Bƿ�����ʳ�ַ�Ӧ����Ӧ��ɺ�____(����ò�Ӧ���еIJ���)�����Ƶ�װ��D������Ϊz g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����Cl2��FeCl2��KSCN�����Һ�ķ�Ӧ����ʵ��̽����
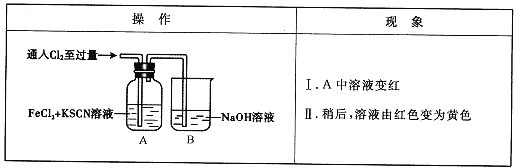
��1��B�з�Ӧ�����ӷ���ʽ��____��
��2��A����Һ����ԭ����____��
��3��Ϊ��̽������II��ԭ��ͬѧ��������ʵ�顣
��ȡA�л�ɫ��Һ���Թ��У�����NaOH��Һ���к��ɫ�������ɣ�����Һ��һ������_____��
��ȡA�л�ɫ��Һ���Թ��У����������KSCN��Һ�����յõ���ɫ��Һ��
��ͬѧ��ʵ��֤��������������ԭ����SCN����Cl2�����˷�Ӧ��
��4����ͬѧ����SCN�����ܱ�Cl2�����ˣ����ֽ����������о���
������ʾ��SCN���ĵ���ʽΪ![]()
����ͬѧ��ΪSCN����̼Ԫ��û�б�������������_________��
��ȡA�л�ɫ��Һ���Թ��У������������ữ��BaCl2��Һ��������ɫ�������ɴ�֤��SCN���б�������Ԫ����__________��
��ͨ��ʵ��֤����SCN���е�Ԫ��ת��ΪNO3-������ʵ�鷽����____��
����SCN����Cl2��Ӧ����1 mol CO2����ת�Ƶ��ӵ����ʵ�����______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����Ļ���������ܱ������з�����Ӧ��mA��g��+nB��g��![]() pC��g�����ﵽƽ��ʱ��ά���¶Ȳ��䣬�����������С��ԭ����1/2�����ﵽ�µ�ƽ��ʱ������C��Ũ�ȱ�Ϊԭƽ��ʱ��1.9����������˵����ȷ���ǣ� ��
pC��g�����ﵽƽ��ʱ��ά���¶Ȳ��䣬�����������С��ԭ����1/2�����ﵽ�µ�ƽ��ʱ������C��Ũ�ȱ�Ϊԭƽ��ʱ��1.9����������˵����ȷ���ǣ� ��
A. m+n��pB. m+n��p
C. ƽ��������Ӧ�����ƶ�D. C��������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com