
【题目】把aL含硫酸铵和硝酸铵的混合液分成两等份,一份需用b mol烧碱刚好把铵根离子全部赶出,另一份与氯化钡溶液反应时,消耗c mol氯化钡,由此可知原溶液中NO3—的物质的量浓度是(单位:mol·L—1) ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
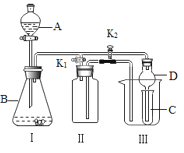
(1)利用I、Ⅱ装置可制取收集气体(K2关闭,K1打开)。
①下列各组物质中能直接利用这套装置进行实验的是_____ (填正确选项的标号)。
A.锌和稀硫酸 B.双氧水和二氧化锰
C.浓氨水和氧化钙 D.浓盐酸和二氧化锰
②在不改变I、II装置及位置的前提下,若要制取收集NO气体,可采取的改进方法是装置II内充满水;若要制取收集NO2气体,可采取的改进方法是:_______________________。
(2)利用I、III装置可验证物质的性质(K2打开,K1关闭)。
①若要证明氧化性:KMnO4>Cl2>Br2,则A中加浓盐酸,B中加KMnO4,C中发生的离子反应方程式___________________________________。
②若要证明乙炔为不饱和烃,则I中发生的化学反应方程式为:_________________。C中的现象为(假设乙炔纯净)________________________________。
(3)装置Ⅲ中使用球形干燥管D的作用为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
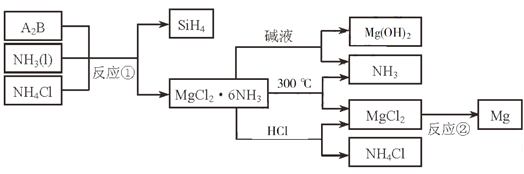
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
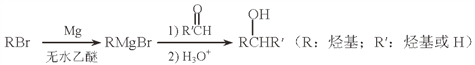
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与水一样,甲醇也能微弱电离:2CH3OH(l)![]() CH3OH2++CH3O-,25℃时,K=2.0×10-17。若往一定量的甲醇中加入金属钠,则有关叙述正确的是( )
CH3OH2++CH3O-,25℃时,K=2.0×10-17。若往一定量的甲醇中加入金属钠,则有关叙述正确的是( )
A. 金属钠与甲醇反应比金属钠与水反应更剧烈
B. 结合H+的能力CH3O-<OH-
C. 所得到溶液中K=c(CH3O-)×c(CH3OH2+)
D. 所得到溶液中c(Na+)=c(CH3OH2+) + c(CH3O-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是不溶物氢氧化铝。其治疗原理是(用离子方程式表示)_______。
(2)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是_______。
(3)反应2H2CrO4+3H2O2=2Cr(OH)3 +3O2↑+2H2O中H2O2的变化过程为H2O2→O2。
①该反应的还原剂是________(填化学式)。
②在该反应方程式中用双线桥法标明电子转移的方向和数目。________
2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
③若反应中转移了3mol电子,则产生的气体在标准状况下体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将饱和的Fe Cl3溶液逐滴滴入沸水中,液体变为红褐色 :
(1)写出反应的化学方程式_____。
(2)将其装入U形管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色_____,这表明__________,这种现象称为_____。
(3)向其中逐滴加入过量稀硫酸,现象是______;原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
(1)标准状况下,0.2 mol氨气的体积是__________, 其中含有的NH3分子数是__________,
(2) 20℃时,饱和KCl溶液的密度为0.745g·cm﹣3,物质的量浓度为4.0 mol·L﹣1,则此溶液中KCl 的质量分数为______
(3)从500 mL 0.2 mol/L Na2SO4 溶液中取出10 mL,取出的Na2SO4溶液物质的量浓度为___mol/L;若将这10 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为______mol/L。
(4)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是______;ACl2的化学式是_________。
(5)物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl-的物质的量之比为________
(6)300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶300mL,反应后溶液中SO42﹣的物质的量的浓度为__________(混合体积看成两液体体积之和)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种重要的化工原料和清洁能源,研究其再生及合理利用有重要意义。
请回答:
(1)已知一定条件下发生如下反应:CO2(g)+2H2O(g)![]() CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
CH4(g)+2O2(g) △H=+802kJ·mol-1。将一定量的CO2(g)和H2O(g)充入10L密闭容器中,分别在催化剂M、N的作用下发生上述反应,CH4(g)的产量(n)与光照时间(t)和温度(T)变化的关系如图1所示。
①若甲烷的燃烧热(△H)为-890kJ·mol-1,则水的汽化热△H=___________。(汽化热指1mol液体转化为气体时吸收的热量)
②T1℃、催化剂M作用下,0~20h内该反应速率v(H2O)=___________,该反应的平衡常数表达式K=___________
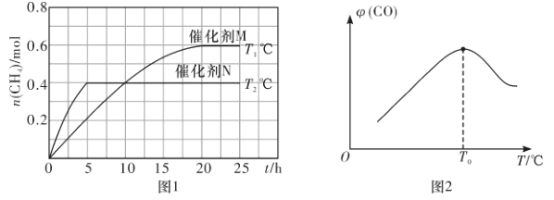
③根据图1判断,T1___________T2(填“>”“<”或“=”),理由为___________。
催化剂的催化效果:M___________N(填“强于”或“弱于”)。
(2)甲烷可用于制备合成气:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(
CO(g)+3H2(g) △H。将CH4(g)和H2O(g)以物质的量之比为1:3充入盛有催化剂的刚性容器中发生该反应。相同时间段内测得CO的体积分数(![]() )与温度(T)的关系如图2所示。T0℃时,CO的体积分数最大的原因为_________________________________。该反应的△H_______0(填“>”“<”)
)与温度(T)的关系如图2所示。T0℃时,CO的体积分数最大的原因为_________________________________。该反应的△H_______0(填“>”“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)海水中蕴含的元素有80多种,它是一个巨大的宝藏。
①海水中被称为海洋元素是___。(填元素名称)
②下列物质不经过化学变化就能从海水中获得的是___。(填字母)
A.单质钠 B.单质碘 C.氯化钠
③加碘食盐中碘酸钾的化学式是___。
(2)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①在该反应的化学方程式上用双线桥标出电子转移的方向和数目___。
②该反应中浓盐酸表现的性质有___。
③如反应中转移了20mol电子,则产生的Cl2在标准状况下体积为__ L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com