
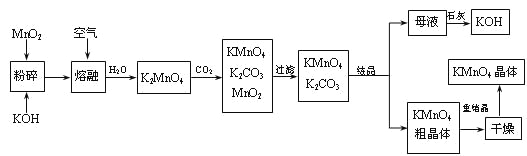
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
【答案】BD 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O K2MnO4 MnO2 KOH 2/3
2K2MnO4+2H2O K2MnO4 MnO2 KOH 2/3
【解析】
(1)KMnO4有强氧化性,消毒原理与84消毒液、双氧水一样;
(2)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水,根据守恒法配平;
(3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,所含元素化合价升高的反应物是还原剂;
(4)制备中利用的原料,在转化过程中又生成的可以循环利用;
(5)根据反应的方程式判断。
(1)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选:BD;
(2)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水,反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂。
(4)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用。
(5)2MnO2+4KOH+O2![]() 2K2MnO4+2H2O可知最初的原料中1mol MnO2恰好得到1mol K2MnO4。由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到2/3molKMnO4。
2K2MnO4+2H2O可知最初的原料中1mol MnO2恰好得到1mol K2MnO4。由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到2/3molKMnO4。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】钠离子电池成本低、安全性好,有望在未来取代锂离子电池,某新型可充电钠离子电池放电的工作原理如图所示。下列分析错误的是( )
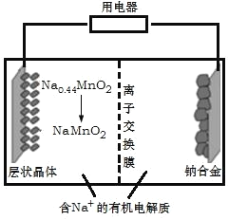
A. 出于环保考虑,应尽量避免使用重金属(如Pb)作为钠的合金化元素
B. 放电时,Na+由右室移向左室
C. 放电时,正极反应式为:Na0.44MnO2+0.56e-+0.56Na+=NaMnO2
D. 充电时,阴极质量变化4.6g时,外电路中通过0.1mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)

(1)由E形成的物质中硬度最大的是___(填名称),属于___(填“晶体类型”)。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是___,该碱溶液与D的最高价氧化物反应的离子方程式___。
(3)常用作光导纤维的是___。
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序___。
(5)H、J、K的最高价氧化物对应水化物的酸性由强到弱的顺序___。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是___。
(7)元素I的氢化物的结构式为___;该氢化物常温下和元素K的单质反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍,A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是__;
(2)已知:
ⅰ.![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ.![]()
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去.

请回答:
①步骤Ⅰ的目的是__;
②若G为气体,且相对分子质量是44,则E的结构简式是__;E的核磁共振氢谱中有__个吸收峰(填数字);
③F→H的反应类型是__;
④F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式__;
⑤A的结构简式是__;
上述转化中B→D的化学方程式是__;
(3)已知A的某种同分异构体K具有如下性质:
①K与FeCl3反应,溶液呈紫色
②K在一定条件下可发生银镜反应
③K分子中苯环上的取代基上无甲基
请写出K所有可能的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取一些重要的化工产品的工艺流程如图所示。
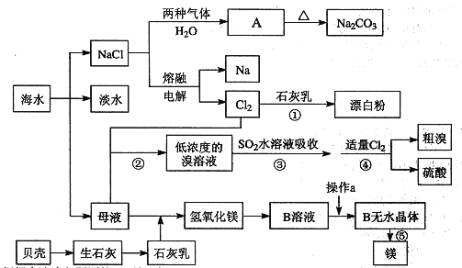
根据上述流程图回答下列问题:
(1)图中A的化学式为 ___________,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为________________。
(2)海水淡化处理的方法有_____________________。(写出2种即可)
(3)过程⑤的化学方程式为 _________________________________。
(4)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式________________________________。
(5)过程②到过程④的变化为“Br→Br2→Br→Br2”,其目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素(F、Cl、Br、I)是典型的非金属元素,它们的单质及化合物在生产生活中用途广泛。请回答下列问题:
(1)氟原子的价电子排布式为___,其原子核外电子能量最高轨道的电子云形状为__。
(2)同主族元素的第一电离能大小存在一定的规律,卤族元素(F、Cl、Br、I)中,第一电离能由大到小的顺序是___。
(3)氯元素价态多样,可以与氧元素形成多种阴离子,其中ClO3的空间构型为__,ClO4中氯原子的杂化方式为____,请写出一种与ClO4互为等电子体的微粒____。
(4)HF的相对分子质量小于HCl,但沸点却高于HCl,原因是____。
(5)CaF2的晶胞结构如图所示,其中氟离子的配位数是___。已知晶胞中相邻最近的两个Ca2+的核间距为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___g·cm3。(列出计算式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO3分解反应为2SO3(g)2SO2(g)+O2(g)。在1.0L密闭容器中加入10mol SO3(g),在一定温度进行上述反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/kPa | 400 | 412 | 422 | 440 | 469 | 518 | 538 | 560 | 560 |
回答下列问题:
(1)欲提高SO3的平衡转化率,应采取的措施为_____(填字母)。
a.增大压强 b.通入SO3 c.降低压强
(2)平衡时SO3的转化率为_____,该温度下的平衡常数Kw=_____
(3)研究表明,SO3(g)分解速率v=4×10﹣3×pSO3(kPamin﹣1),t=6h时,测得体系中pO2=55kPa,则此时的pSO3=_____kPa,v(SO3)=_____kPamin﹣1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com