
����Ŀ���Ӻ�ˮ����ȡһЩ��Ҫ�Ļ�����Ʒ�Ĺ���������ͼ��ʾ��
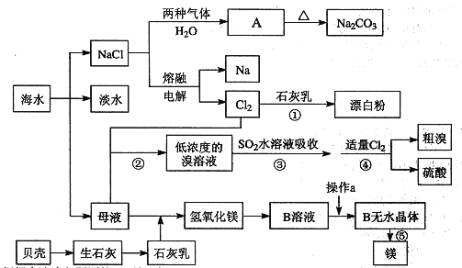
������������ͼ�ش��������⣺
(1)ͼ��A�Ļ�ѧʽΪ ___________������ȡA�Ĺ���������NaCl��Һ���Ⱥ�ͨ���������壬��ͨ������Ļ�ѧʽΪ________________��
(2)��ˮ���������ķ�����_____________________����д��2�ּ��ɣ�
(3)���̢ݵĻ�ѧ����ʽΪ _________________________________��
(4)���̢���SO2ˮ��Һ�����嵥�ʣ������ʿɴ�93%����������ǿ�ᣬд����Ӧ�����ӷ���ʽ________________________________��
(5)���̢ڵ����̢ܵı仯Ϊ��Br��Br2��Br��Br2������Ŀ����__________��
���𰸡�NaHCO3 CO2 MgCl2![]() Mg+Cl2�� �������ӽ��������������� Br2+SO2+2H2O=4H++2Br-+SO42- ������
Mg+Cl2�� �������ӽ��������������� Br2+SO2+2H2O=4H++2Br-+SO42- ������
��������
������������ͼ��������ˮͨ����ˮɹ�Ρ���ˮ�����õ��Ȼ��ơ�ĸҺ���Ȼ�����Һ��ͨ�백����������̼������Ӧ����̼�����ƾ���A���Ȼ�泥�̼�����ƾ������ȷֽ�����̼���ơ�������̼��ˮ���õ������Ȼ���ͨ����������Ȼ��Ƶõ��������ƣ�����ͨ��ʯ���鷴Ӧ�����Ȼ��ơ�������ƺ�ˮ�����õ�Ư�ۣ�����ͨ��ĸҺ�У����������������ɵ�Ũ�ȵ��嵥����Һ���ö������������嵥�����������ӣ���ͨ��ͨ���������������������嵥�ʣ��ڹ����и������壬�õ���������ᡣ���Ƿֽ�������ʯ������ˮ�õ�ʯ���飬����ĸҺ�У��ɳ���þ��������������þ���������˺���������ܽ�������þ�õ�B��ҺΪ�Ȼ�þ��Һ��Ȼ�����Ȼ��������������Ȼ�þ��Һ�õ���ˮ�Ȼ�þ����������Ȼ�þ����þ��������
(1)����A���ȷֽ�����Na2CO3֪��A�Ļ�ѧʽΪ NaHCO3������A�ķ����Ǻ����Ƽ����ΪNH3��������ˮ����CO2��ˮ���ܽ�Ȳ��ϣ���������ˮ��Ϊ�˻�ý϶��NaHCO3���壬Ҫ����ʳ��ˮ��ͨ�백���������Ϳ����ո����CO2����������NaHCO3����������ȡNaHCO3�Ĺ���������NaCl��Һ����ͨ��NH3����ͨ��CO2��(2)��ˮ���������ķ����������������������ӽ���Ĥ���ȣ�
(3)���̢�ӦΪ������ڵ���ˮMgCl2��ȡMg����ѧ����ʽΪMgCl2(����)![]() Mg+Cl2����
Mg+Cl2����
(4)���̢���SO2����ˮ����������Ҳ�����ᣬ��Ӧ�����ӷ���ʽΪSO2+Br2+2H2O=4H++SO42-+2Br-��
(5)���ں�ˮ����Ļ�����Ũ��С�����Թ��̢ڵõ����ǵ��嵥����Һ��Ũ��̫�ͣ����Թ��̢ڵ����̢ܵı仯ΪBr-��Br2��Br-��Br2����Ŀ�����������Ũ�ȣ�ʵ����ĸ�����


 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӱ������ֿ����ʼ��������ı仯�����������Ǹ��������ȥ������ѧ֪ʶ���ں�������Ӧ�á����ڡ�ԭ��ء��ⲿ��֪ʶҲ����ˣ���ͼ��ԭ��صĻ�������ģ�ͣ�

��1����a��b�ĵ缫����ΪAl��Mg��
����cΪϡNaOH��Һʱ����a�ĵ缫����Ϊ__���ü��缫����ʽΪ___��
����cΪϡH2SO4ʱ����a�ĵ缫����Ϊ___���ü��缫����ʽΪ__��
��2������ԭ��ص�Ӧ�ã�����˵����ȷ����__��
A.ѡ��ԭ�����������ʱ������ѡ������Բ�ͬ�����ֽ�������
B.����ԭ���ʱ���������ϵĻ�����һ�����������ϵ�ǿ
C.����ԭ���ʱ����Ϊ�������ϵĽ����ܵ�����
D.������ת���Ƕ�ȥ������ͼ��������ԭ��Ӧ�����仯���ߣ����ܹ����ԭ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������Ҫ�Ľ������ϡ�ˮ�����ϵ���Ҫ�ɷ�ΪCaO��SiO2��������һ��������������þ�Ƚ����������ʵ���Ҳⶨˮ����Ʒ�иƺ����Ĺ�����ͼ��ʾ��

�ش��������⣺
��1���ڷֽ�ˮ����Ʒ�����У�������Ϊ�ܼ����Ȼ��Ϊ���ܼ���������뼸�����ᡣ���������Ŀ����__________������ʹ��___________�������ᡣ
��2������A����Ҫ�ɷ���_________���䲻����ǿ�ᵫ����һ�����ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��3���Ӱ�ˮ�����м��ȵ�Ŀ����___________������B����Ҫ�ɷ�Ϊ_____________��____________���ѧʽ����
��4������Ƴ�����ϡH2SO4��������KMnO4����Һ�ζ���ͨ���ⶨ��������ɼ�ӻ�֪�Ƶĺ������ζ���ӦΪ�� ![]() +H++H2C2O4��Mn2++CO2+H2O��ʵ���г�ȡ0.400 gˮ����Ʒ���ζ�ʱ������0.0500 mol��L-1��KMnO4��Һ36.00 mL�����ˮ����Ʒ�иƵ���������Ϊ______________��
+H++H2C2O4��Mn2++CO2+H2O��ʵ���г�ȡ0.400 gˮ����Ʒ���ζ�ʱ������0.0500 mol��L-1��KMnO4��Һ36.00 mL�����ˮ����Ʒ�иƵ���������Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��ͼ�б�ʾNO2�ı仯��������___(����ĸ)��
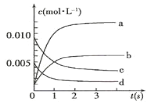
��2��800�棬��Ӧ�ﵽƽ��ʱ��NO��ת������___����
��3����O2��ʾ��0~2s�ڸ÷�Ӧ��ƽ������v=___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������̵���Ҫ������ͳ��õ��������������ǹ�ҵ�������̿��Ʊ�������ص�һ�ֹ������̡�
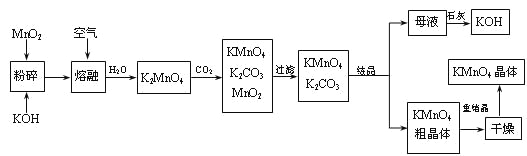
��1��KMnO4ϡ��Һ��һ�ֳ��õ�������������������������___������ţ��������ơ�
A��75%�ƾ� B��˫��ˮ C������ D��84����Һ��NaClO��Һ��
��2��д��MnO2��KOH�����ڻ������ͨ�����ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽ��
___________________________________________________________________��
��3����K2MnO4��Һ��ͨ��CO2���Ʊ�KMnO4���÷�Ӧ�еĻ�ԭ���ǣ�_______��
��4�����������п���ѭ��ʹ�õ�������ʯ�ҡ�������̼��___��___��д��ѧʽ����
��5��������������ѭ�����Ʊ������е���ʧ����1 mol MnO2���Ƶ�_____mol KMnO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(PCl3)��һ�������л��ϳɵ���Ҫ������ʵ���ҳ��ú���������Cl2��ȡPCl3��װ����ͼ��ʾ��
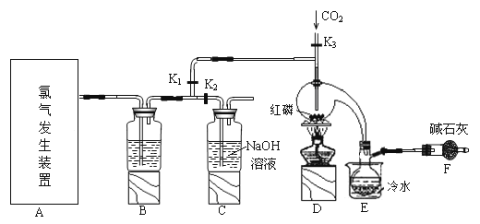
��֪������������Cl2��Ӧ����PCl3�������Cl2��Ӧ����PCl5��PCl3��O2������POCl3(��������)�� POCl3����PCl3��PCl3��ˮ��ǿ��ˮ������H3PO3��HCl��PCl3��POCl3���۷е���±���
���� | ��Է������� | �۵�/�� | �е�/�� |
PCl3 | 137.5 | -112 | 75.5 |
POCl3 | 153.5 | 2 | 105.3 |
��ش��������⣺
��1�������ͼ��ѡ���Ʊ������ķ���װ��
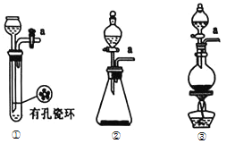
��ѡ�õ�װ����____������ţ�����Ӧ�����ӷ���ʽΪ____��
��2��B����ʢ�Լ���_____��
��3��E����ˮ��������____��
��4������F��������____��F�м�ʯ�ҵ�������___��
��5��ʵ���ƵõĴֲ�Ʒ�г�����POCl3��PCl5�ȣ���������ȳ�ȥPCl5����ͨ��__����������ƣ����ɵõ��ϴ�����PCl3��
��6��ͨ�����淽���ɲⶨ��Ʒ��PCl3������������
��Ѹ�ٳ�ȡ1.00g��Ʒ����ˮ��Ӧ�����250mL��Һ��
��ȡ������Һ25.00mL�������м���10.00mL0.1000mol/L��ˮ(����)����ַ�Ӧ��
�����������Һ�м��뼸�ε�����Һ����0.1000 mol/L��Na2S2O3��Һ�ζ���
���ظ��ڡ��۲�����ƽ������0.1000 mol/LNa2S2O3��Һ8.00mL��
��֪��H3PO3+I2+H2O=H3PO4+2HI��I2+2Na2S2O3=2NaI+Na2S4O6�������������ݣ�����ⶨ������û��������Ӧ���ò�Ʒ��PCl3����������Ϊ___������3λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2L���ܱ�������ͨ���������巢����ѧ��Ӧ����Ӧ�и����ʵ����ʵ����仯��ͼ��ʾ��6sʱ��Ӧ�Ѵﵽƽ��״̬�����Ը÷�Ӧ���ƶ���ȷ���ǣ� ��

A���÷�Ӧ�Ļ�ѧ����ʽΪ3B+4D6A+2C
B����Ӧ���е�1sʱ��v��A��=v��C��
C����Ӧ���е�6sʱ��B��D�����ʵ���Ũ�Ⱦ�Ϊ0.4molL��1
D����Ӧ���е�6sʱ��B��ƽ����Ӧ����Ϊ0.05mol/��Ls��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ�ΪAl2O3��SiO2�������������������ʣ��������������Ʊ�Al��OH��3�������£����û�ѧ�Լ�����������
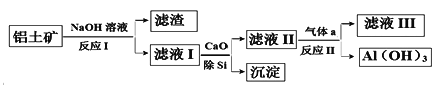
����˵������ȷ����
A. Al��OH��3��������������
B. ��CaO��Si�õ��ij�����Ҫ�ɷ�ΪH2SiO3
C. ����a�ɷ�ΪCO2
D. ��ҺIII������ΪCa��HCO3��2��NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ���ܽ��ȶ����ڵ��ȵ���������Cl2O��ClO2��Cl2O7�ȡ��й����ݼ�����
��ѧʽ | Cl2O | ClO2 | Cl2O7 |
�е�/�� | 3.8 | 11.0 | 82.0 |
��ش��������⣺
(1)���¡���ѹ�£������������������������__________��
(2)Cl2O7�����������������ˮ��Ӧ�����ӷ���ʽΪ__________��
(3)ClO2��һ�ֳ��õ����������ҹ���2000��������ClO2��������������ˮ����������������ˮʱ��ClO2���ɽ�ˮ�е�Fe2+��Mn2+��ת����Fe(OH)3��MnO2���������ȥ��˵��ClO2����__________�ԡ�
(4)��ҵ�Ͽ��������з�Ӧ�Ʊ�ClO2��2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4�����õ����ŷ���ʾ���÷�Ӧ����ת�Ƶķ������Ŀ______________��
(5)��ҵ���Ʊ�ClO2�ķ�Ӧԭ��Ϊ��2NaClO3+4HCl(Ũ)=2ClO2��+Cl2��+2H2O+2NaCl��
��Ũ�����ڷ�Ӧ����ʾ������������__________(�����)��
A����ԭ�� B�������� C������
����������Ӧ�в���0.1molClO2����ת�Ƶĵ�����Ϊ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com