
【题目】铝土矿的主要成分为Al2O3和SiO2(含有少量不溶性杂质),利用铝土矿制备Al(OH)3流程如下(所用化学试剂均过量)。
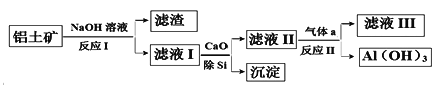
下列说法不正确的是
A. Al(OH)3可用作治疗胃酸过多
B. 加CaO除Si得到的沉淀主要成分为H2SiO3
C. 气体a成分为CO2
D. 滤液III中溶质为Ca(HCO3)2和NaHCO3
【答案】B
【解析】铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为偏铝酸钠和硅酸钠,且含有过量的氢氧化钠,滤渣为杂质;在滤液Ⅰ中加入氧化钙,氧化钙和水反应生成氢氧化钙,进而生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠和氢氧化钙,可通入过量的二氧化碳气体,生成氢氧化铝,滤液为碳酸氢钠和碳酸氢钙。Al(OH)3为弱碱,中和胃液中盐酸,因此Al(OH)3可用作治疗胃酸过多,A正确;根据以上分析可知,得到的沉淀主要成分为硅酸钙,B错误;氢氧化铝不溶于弱酸,因此偏铝酸钠溶液中通过量的二氧化碳气体,生成氢氧化铝, C正确;根据以上分析可知,滤液III中溶质为Ca(HCO3)2和NaHCO3,D正确;正确选项B。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) ![]() bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
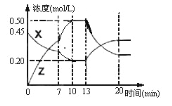
A. 根据上图可求得方程式中a∶b=1:3
B. 推测在第7min时曲线变化的原因可能是升温
C. 推测在第13min时曲线变化的原因可能是降温
D. 用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取一些重要的化工产品的工艺流程如图所示。
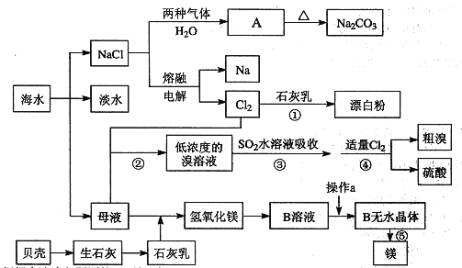
根据上述流程图回答下列问题:
(1)图中A的化学式为 ___________,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为________________。
(2)海水淡化处理的方法有_____________________。(写出2种即可)
(3)过程⑤的化学方程式为 _________________________________。
(4)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式________________________________。
(5)过程②到过程④的变化为“Br→Br2→Br→Br2”,其目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是
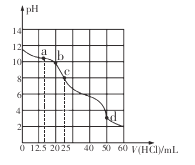
A. a点:c( HCO3-)>c(Cl-)>c(C032-)
B. b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH-)
C. c点:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D. d点:c(Cl-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化碳是一种灰白色粉末,熔点为94~95℃,广泛用于有机化合物的溴代、农药的制备等。某合作学习小组的同学拟用丙酮和液溴制备四溴化碳,其原理为CH3COCH3+4Br2+5NaOH→CBr4+CH3COONa+4NaBr+4H2O。回答下列问题:
Ⅰ.制取Br2
(1)甲组同学拟用溴化钠、二氧化锰及浓硫酸制备液溴,其实验装置如图1所示:
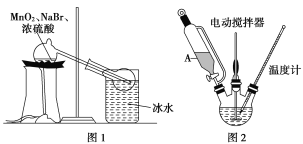
①该装置不用橡皮塞及橡皮管,其原因是___________________;
②冰水的作用是__________________________。
Ⅱ.制取CBr4
(2)乙组同学拟利用甲组同学制得的液溴与CH3COCH3(沸点56.5℃)等试剂制取四溴化碳。实验步骤如下:
步骤1:向图2中三颈烧瓶中加入11.4 g NaOH和46 mL水,搅拌。
步骤2:冰水浴冷却至2℃时,开始不断滴加液溴20 g,滴加完毕后在5℃下保持20 min。
步骤3:加入少量相转移试剂,在不断搅拌下滴入1.6 g丙酮,维持温度在5~10℃,连续搅拌4 h。
步骤4:过滤、冷水洗涤、减压烘干,得产品8.3 g。
①步骤2滴入Br2之前,冷却至2℃的目的是__________________________
②步骤4洗涤时,如何证明已洗涤干净: ___________________________。
③本次实验中产品的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是从元素周期表中截取下来的,甲、乙、丙为短周期主族元素,下列说法中正确的是( )
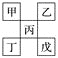
A. 丁一定是金属元素,其金属性比丙强
B. 丙的最高价氧化物水化物显强酸性
C. 乙的氢化物是以分子形式存在,且分子间存在氢键
D. 戊的原子序数一定是甲的5倍,且原子半径比甲大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不能说明CO2是酸性氧化物的是( )
A.Na2CO3+H2SO4═CO2↑+H2O+Na2SO4
B.CO2+2NaOH═Na2CO3+H2O
C.CO2+2Mg![]() 2MgO+C
2MgO+C
D.CO2+Na2O=Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com