
【题目】将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示,请回答下列问题:

(1)元素⑨在周期表中的位置是_______。
(2)元素①~⑨中,非金属性最强的元素是_______(填元素符号)。
(3)元素①~⑨中,最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),它与元素⑤的最高价氧化物对应水化物反应的离子方程式为_______。
(4)元素⑨的简单氢化物与元素⑦的简单氢化物中更稳定的是_______(填化学式)。
(5)元素③与元素①形成的淡黄色化合物的电子式为_______。
(6)元素①的简单氢化物比元素⑥的简单氢化物的沸点_______(填“高”或“低”),原因是_______。
(7)元素④与元素⑦形成的化合物是_______(填“离子”或“共价”)化合物,用电子式表示其形成过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程如图:
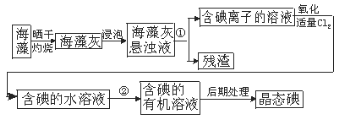
(1)指出制取碘的过程中有关的实验操作名称:
①_________________________
②_________________________
(2)提取碘的过程中.可供选择的有机试剂是_______________。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是____________。
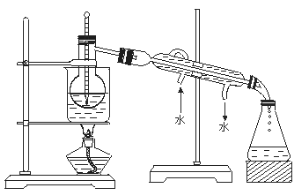
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏。观察上述实验装置指出其错误之处,并加以改正。_____________________________________________________________
(5)进行上述蒸馏操作时,使用水浴的原因是________________________________。最后晶态碘在______________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-===PbSO4正极PbO2+4H++SO42-+2e-===PbSO4+2H2O
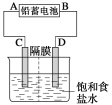
(1)请写出电解饱和食盐水的化学方程式____________。
(2)若在电解池D极滴酚酞试液,电解一段时间后呈红色,说明铅蓄电池的B极为___极。
(3)用铅蓄电池电解2 L饱和食盐水(电解过程假设体积不变)
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
③若消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的物质的量浓度为(假设氯气全部排出)______________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种常见的化学电源示意图,有关说法不正确的是( )

A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.含氮化合物在工农业生产中都有重要应用。
(1)己知:
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1
2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2
N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2
则用NH3和O2制取N2H4的热化学方程式为__________________________________,该反应的化学平衡常数K=_______(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(
N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(![]() )随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=______,平衡时NO的转化率为________。
)随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=______,平衡时NO的转化率为________。

Ⅱ.2NH3(g)+CO2(g)![]() NH2COONH4(s)
NH2COONH4(s)
(3)该反应能正向自发进行的原因是_____________________。
(4)恒温恒容下通入2 mol NH3和1 mol CO2进行上述反应,下列事实能证明反应已达平衡的是__________。
A.体系压强保持不变 B.气体平均密度保持不变
C.气体的平均摩尔质量保持不变 D.氨气的体积分数不变
Ⅲ.在恒温恒压条件下,向某密闭容器中通入2 mol SO2和1 mol O2,发生2SO2(g)+O2(g)![]() 2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像________。
2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com