
【题目】下列反应中,不能说明CO2是酸性氧化物的是( )
A.Na2CO3+H2SO4═CO2↑+H2O+Na2SO4
B.CO2+2NaOH═Na2CO3+H2O
C.CO2+2Mg![]() 2MgO+C
2MgO+C
D.CO2+Na2O=Na2CO3
【答案】C
【解析】
酸性氧化物是一类能与水作用生成相应价态的酸,或与碱作用生成盐和水(且生成物只能有一种盐和水,不可以有任何其它物质生成),或与碱性氧化物反应生成盐的氧化物。
A.Na2CO3+H2SO4═CO2↑+H2O+Na2SO4该反应可以用以证明碳酸酸性比硫酸酸性弱,且碳酸不稳定分解为二氧化碳和水,即反之说明二氧化碳与水反应生成碳酸,证明为酸性氧化物,A错误;
B.CO2+2NaOH═Na2CO3+H2O证明二氧化碳能与碱性物质反应生成盐和水,说明是酸性氧化物,B错误;
C.CO2+2Mg![]() 2MgO+C说明镁的还原性强于碳,与是否为酸性氧化物无关,C正确;
2MgO+C说明镁的还原性强于碳,与是否为酸性氧化物无关,C正确;
D.CO2+Na2O=Na2CO3为化合反应,与碱性氧化物反应生成盐,D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是___(填字母);
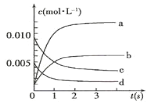
(2)800℃,反应达到平衡时,NO的转化率是___ ;
(3)用O2表示从0~2s内该反应的平均速率v=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分为Al2O3和SiO2(含有少量不溶性杂质),利用铝土矿制备Al(OH)3流程如下(所用化学试剂均过量)。
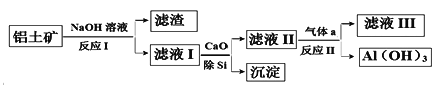
下列说法不正确的是
A. Al(OH)3可用作治疗胃酸过多
B. 加CaO除Si得到的沉淀主要成分为H2SiO3
C. 气体a成分为CO2
D. 滤液III中溶质为Ca(HCO3)2和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业食盐中含Ca2+、Mg2+等杂质,某厂电解饱和食盐水制取NaOH溶液的工艺流程如图所示,回答下列问题:
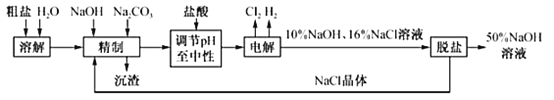
(1)“精制”过程中发生反应的离子方程式为_____
(2)若粗盐中SO42﹣含量也较高,沉淀剂可以是_____(填字母)且要在试剂Na2CO3之_____加入(填“前”或“后”)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)在电解过程中,产生H2的电极与外接电源的_____极相连;溶液pH增大的区域是_____(填“阳极区”或“阴极区”)。
(4)烧碱和氯气是电解饱和食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_____(填写计算表达式和结果且结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为短周期元素,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)

(1)上述元素中金属性最强和非金属性最强的元素名称分别是___、___;
(2)①和②的气态氢化物稳定性较强的是(写化学式):___;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为___;写出⑤单质与③的最高价氧化物对应水化物反应的化学方程式为___。描述H2在⑧单质中燃烧的现象___。
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是___;
(5)比较②和③对应简单离子的离子半径较小的是(用相应离子符号表示)___。
(6)写出③的最高价氧化物对应水化物的电子式___;其含有的化学键类型是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣的数目为 NA
B.0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
C.标准状况下,22.4LH2O含有的分子数为NA
D.一定条件下2.3gNa与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是__________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为__________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有__________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是__________(填序号)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾在日常生活中用途非常广泛。用废铝灰(含Al、Al2O3、Fe、Fe2O3、FeO 等)为原料制取明矾的工艺流程如下图。回答下列问题:
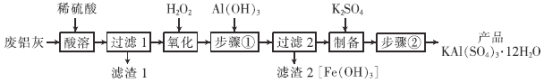
已知:Fe3+开始沉淀到沉淀完全时溶液的pH 为1.9~3.7。
(1)明矾净水的原理是_______________________(用离子方程式表示)。
(2)“酸溶”时,Al2O3溶解的化学方程式为______________________。
(3)“氧化”时,发生反应的离子方程式为_______________。
(4)“步骤①”的目的是______;“滤渣2”经碱洗、水洗、干燥和煅烧,得到的产品的名称是_____(填俗称)。
(5)“步骤②”包含的操作有_________、__________、过滤及干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某工厂排放出有毒物质NOCl,它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_____。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为____
(二)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:2FeCl3+Cu==2FeCl2+CuCl2。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
①取少量废液,滴加KSCN溶液显红色。
②取100mL废液,加入足量的AgNO3溶液,析出沉淀43.05g。
③另取100mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了2.56g,再向反应后的溶液中滴加KSCN溶液不变色。
根据探究实验得出结论:
(1)废液中含有的金属离子是______。
(2)100mL废液中Cl-的物质的量是______。
(3)原100mL废液中铜离子的物质的量浓度是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com