
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣的数目为 NA
B.0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
C.标准状况下,22.4LH2O含有的分子数为NA
D.一定条件下2.3gNa与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA
科目:高中化学 来源: 题型:
【题目】工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3与NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
(一)提供的装置
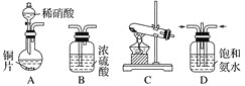

(二)NH3的制取
(1)下列有关实验室制备气体的说法正确的是__________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管
(2)从所提供的装置中选取一个能制取氨气的装置:________________(填序号)。
(3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是___________。
(三)模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
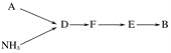
(4)A中反应的离子方程式为___________。
(5)D装置中的液体可换成________(填序号)。
a CuSO4 b H2O c CCl4 d 浓硫酸
(6)该同学所设计的模拟尾气处理实验还存在的明显缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化碳是一种灰白色粉末,熔点为94~95℃,广泛用于有机化合物的溴代、农药的制备等。某合作学习小组的同学拟用丙酮和液溴制备四溴化碳,其原理为CH3COCH3+4Br2+5NaOH→CBr4+CH3COONa+4NaBr+4H2O。回答下列问题:
Ⅰ.制取Br2
(1)甲组同学拟用溴化钠、二氧化锰及浓硫酸制备液溴,其实验装置如图1所示:
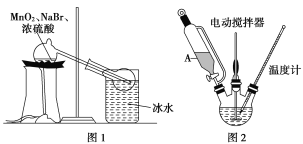
①该装置不用橡皮塞及橡皮管,其原因是___________________;
②冰水的作用是__________________________。
Ⅱ.制取CBr4
(2)乙组同学拟利用甲组同学制得的液溴与CH3COCH3(沸点56.5℃)等试剂制取四溴化碳。实验步骤如下:
步骤1:向图2中三颈烧瓶中加入11.4 g NaOH和46 mL水,搅拌。
步骤2:冰水浴冷却至2℃时,开始不断滴加液溴20 g,滴加完毕后在5℃下保持20 min。
步骤3:加入少量相转移试剂,在不断搅拌下滴入1.6 g丙酮,维持温度在5~10℃,连续搅拌4 h。
步骤4:过滤、冷水洗涤、减压烘干,得产品8.3 g。
①步骤2滴入Br2之前,冷却至2℃的目的是__________________________
②步骤4洗涤时,如何证明已洗涤干净: ___________________________。
③本次实验中产品的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A. 该温度下,BaSO4的Ksp=8×10﹣10 B. M点和P点对应的Ksp相等
C. N点无BaSO4沉淀生成 D. 加入Na2SO4可以使溶液由Q点变到P点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不能说明CO2是酸性氧化物的是( )
A.Na2CO3+H2SO4═CO2↑+H2O+Na2SO4
B.CO2+2NaOH═Na2CO3+H2O
C.CO2+2Mg![]() 2MgO+C
2MgO+C
D.CO2+Na2O=Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是( )
2AlN+3CO合成。已知AlN可与NaOH溶液反应放出有刺激性气味的气体。下列叙述正确的是( )
A.AlN中氮元素的化合价为+3
B.上述反应中,N2是还原剂,Al2O3是氧化剂
C.上述反应中,每生成1molAlN需转移6mol电子
D.AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理是研究和学习化学的重要依据。回答下列问题:
(1)已知氢气的燃烧热△H=﹣285.5kJmol﹣1,则电解水的热化学方程式为_____
(2)在298K、101kPa下,2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1,则相同条件下,2mol SO2和 1 mol O2充分反应,最终放出的热量_____198kJ(填“大于”“小于或“等于”);该反应的平衡常数表达式K=_____。
(3)25℃时,下表为一些难溶电解质的相关数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 5.8 | 4.1 | 2.0 |
完全沉淀时的pH | 8.3 | 6.4 | 3.2 |
常温下,除去酸性CuCl2溶液中含有的少量FeCl2,其操作步骤为:
①应先加入_____(填试剂名称),发生的离子反应方程式为_____
②再加入CuO,调节溶液的pH在_____范围内,使溶液中的Fe3+转化为Fe(OH)3沉淀,过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
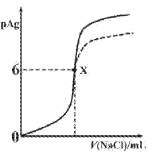
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com