
【题目】工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3与NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
(一)提供的装置
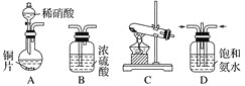

(二)NH3的制取
(1)下列有关实验室制备气体的说法正确的是__________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管
(2)从所提供的装置中选取一个能制取氨气的装置:________________(填序号)。
(3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是___________。
(三)模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
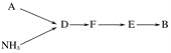
(4)A中反应的离子方程式为___________。
(5)D装置中的液体可换成________(填序号)。
a CuSO4 b H2O c CCl4 d 浓硫酸
(6)该同学所设计的模拟尾气处理实验还存在的明显缺陷是________________。
【答案】①③⑤ C或G 2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O或CaO+NH3·H2O=NH3↑+Ca(OH)2(要对应) 3Cu+2NO3+8H+=3Cu2++2NO↑+4H2O c NO尾气直接排放,没有进行处理
2NH3↑+CaCl2+2H2O或CaO+NH3·H2O=NH3↑+Ca(OH)2(要对应) 3Cu+2NO3+8H+=3Cu2++2NO↑+4H2O c NO尾气直接排放,没有进行处理
【解析】
(1)①氯气在饱和食盐水中的溶解度较小,可以用排饱和食盐水的方法收集氯气,①正确;
②用赤热的炭与水蒸气反应生成CO、H2,制取的氢气含有杂质,②错误;
③实验室制氧气,用高锰酸钾或氯酸钾时需要加热,用过氧化氢时不需要加热,③正确;
④氯化钙与氨气可形成配合物,不能用无水氯化钙干燥氨气,④错误;
⑤用高锰酸钾制取氧气后剩余的固体为二氧化锰、高锰酸钾,均可与浓盐酸反应生成可溶性的二氯化锰,故可用浓盐酸洗涤高锰酸钾分解制氧气的试管,⑤正确;
故答案为:①③⑤;
(2)实验室制备氨气可用氢氧化钙与氯化铵固体加热法,也可以用浓氨水与氢氧化钠(或氧化钙)在常温下制取。可选装置C或G,故答案为:C或G;
(3)根据所选装置,相应制备氨气的化学方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O或CaO+NH3·H2O=NH3↑+Ca(OH)2(要对应),故答案为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O或CaO+NH3·H2O=NH3↑+Ca(OH)2(要对应),故答案为:2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O或CaO+NH3·H2O=NH3↑+Ca(OH)2;
2NH3↑+CaCl2+2H2O或CaO+NH3·H2O=NH3↑+Ca(OH)2;
(4)A中为Cu与稀硝酸的反应:3Cu+2 NO3+8H+=3Cu2++2NO↑+4H2O,故答案为:3Cu+2 NO3+8H+=3Cu2++2NO↑+4H2O;
(5)D中用饱和氨水防止氨气被吸收,因此还可以换成CCl4,故答案为:c;
(6)该反应中尾气含有NO等污染性气体,应除去后再排空,故答案为:NO尾气直接排放,没有进行处理。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应X(g)+2Y(g) ![]() 2Z(g)。下列叙述能判断该反应达到化学平衡的是
2Z(g)。下列叙述能判断该反应达到化学平衡的是
① X、Y、Z的物质的量之比是1∶2∶2 ② X、Y、Z的浓度不再发生变化③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时消耗n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 已知HI(g) ![]() 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C. 已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡等,请回答下列问题。
(1)已知部分弱电解质的电离常数如下表:
弱电解质 | NH3.H2O | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Kb = 1.8×10 5 | Ka = 1. 77×10 4 | Ka=4.3×1010 | Ka1=5.0×107 Ka2=5.6×1011 |
① 已知25℃时,HCOOH( aq) +OH ( aq)=HCOO(aq) +H2O(l) △H=a kJ/mol H+(aq) +OH(aq) =H2O(l) △H=b kJ/mol 甲酸电离的热化学方程式为______________。
②取浓度相同的上述三种酸溶液,溶液pH最大的是_________,稀释相同的倍数后,溶液pH变化最大的是____________________。
③分别取等浓度、等体积HCOOH和HCN溶液,加入同浓度的NaOH溶液中和,当溶液呈中性时消耗NaOH溶液的体积:V (HCOOH)______ V (HCN) (填“>”、“<”或“=”)。
④0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN)______c(HCO3 )(填“>”、“<”或“=”)。
⑤常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是_____________(填编号)。
⑥将少量CO2通入NaCN溶液,反应的离子方程式是__________________________________。
⑦若NH3·H2O与CO2恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。向该溶液中通入________气体可使溶液呈中性(填“CO2”或“NH3”)。此时溶液中c(NH4+)/c(CO3 2) ________2(填“>”“<”或“=”)
(2)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

① HA的电离方程式是____________________________
② a、b、c处溶液中水的电离程度最大的是_______________
③ c点所示的溶液中除水分子外的微粒浓度由大到小的顺序依次为______________________________。
(3)常温下,将等体积0.1 molL-1NaOH和n molL-1HA混合,溶液呈中性,该温度下HA的电离常数Ka=___________(用含有n的式子表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是___(填字母);
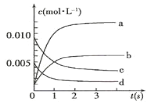
(2)800℃,反应达到平衡时,NO的转化率是___ ;
(3)用O2表示从0~2s内该反应的平均速率v=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FFC电解法可由金属氧化物直接电解制备金属单质,西北稀有金属材料研究院利用此法成功电解制备钽粉(Ta),其原理如图所示。下列说法正确的是
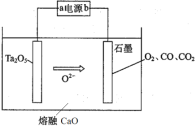
A. 该装置将化学能转化为电能
B. a极为电源的正极
C. Ta2O5极发生的电极反应为Ta2O5 +10e = 2Ta+5O2
D. 常温常压下,石墨电极上生成22.4LO2,则电路中转移的电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。
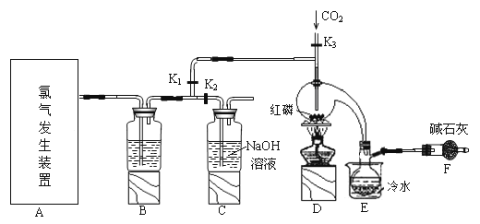
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ |
PCl3 | 137.5 | -112 | 75.5 |
POCl3 | 153.5 | 2 | 105.3 |
请回答下列问题:
(1)请从下图中选择制备氯气的发生装置
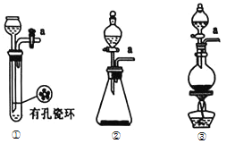
你选用的装置是____(填序号),反应的离子方程式为____。
(2)B中所盛试剂是_____。
(3)E中冷水的作用是____。
(4)仪器F的名称是____;F中碱石灰的作用是___。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过__(填操作名称)即可得到较纯净的PCl3。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/LNa2S2O3溶液8.00mL。
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为___(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣的数目为 NA
B.0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
C.标准状况下,22.4LH2O含有的分子数为NA
D.一定条件下2.3gNa与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com