
【题目】电解质水溶液中存在电离平衡、水解平衡等,请回答下列问题。
(1)已知部分弱电解质的电离常数如下表:
弱电解质 | NH3.H2O | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Kb = 1.8×10 5 | Ka = 1. 77×10 4 | Ka=4.3×1010 | Ka1=5.0×107 Ka2=5.6×1011 |
① 已知25℃时,HCOOH( aq) +OH ( aq)=HCOO(aq) +H2O(l) △H=a kJ/mol H+(aq) +OH(aq) =H2O(l) △H=b kJ/mol 甲酸电离的热化学方程式为______________。
②取浓度相同的上述三种酸溶液,溶液pH最大的是_________,稀释相同的倍数后,溶液pH变化最大的是____________________。
③分别取等浓度、等体积HCOOH和HCN溶液,加入同浓度的NaOH溶液中和,当溶液呈中性时消耗NaOH溶液的体积:V (HCOOH)______ V (HCN) (填“>”、“<”或“=”)。
④0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN)______c(HCO3 )(填“>”、“<”或“=”)。
⑤常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是_____________(填编号)。
⑥将少量CO2通入NaCN溶液,反应的离子方程式是__________________________________。
⑦若NH3·H2O与CO2恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。向该溶液中通入________气体可使溶液呈中性(填“CO2”或“NH3”)。此时溶液中c(NH4+)/c(CO3 2) ________2(填“>”“<”或“=”)
(2)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

① HA的电离方程式是____________________________
② a、b、c处溶液中水的电离程度最大的是_______________
③ c点所示的溶液中除水分子外的微粒浓度由大到小的顺序依次为______________________________。
(3)常温下,将等体积0.1 molL-1NaOH和n molL-1HA混合,溶液呈中性,该温度下HA的电离常数Ka=___________(用含有n的式子表达)
【答案】HCOOH(aq)![]() HCOO(aq)+H+(aq) △H=( b a)kJ/mol HCN HCOOH > < abc CN+CO2+H2O=HCN+HCO3 碱性 CO2 > HA
HCOO(aq)+H+(aq) △H=( b a)kJ/mol HCN HCOOH > < abc CN+CO2+H2O=HCN+HCO3 碱性 CO2 > HA![]() H++ A b c(A)>c(Na+)> c(HA)>c(H+)>c(OH) 10-8/(n-0.1)
H++ A b c(A)>c(Na+)> c(HA)>c(H+)>c(OH) 10-8/(n-0.1)
【解析】
(1)①利用盖斯定律得到电离方程式;
②根据电离常数确定酸性强弱,得出结论;
③要想使溶液呈中性,酸性越弱所需NaOH体积越小;
④根据电离常数得到酸性强弱,再根据越弱越水解的原理比较离子浓度;
⑤根据电离常数得到酸性强弱,再根据越弱越水解的原理比较物质的量浓度;
⑥根据电离常数可知酸性H2CO3>HCN>HCO3-,强酸之弱酸原理书写离子方程式;
⑦根据电离常数判断;
(2)① 根据b点溶液显碱性可以判断生成了强酸弱碱盐,所以HA为弱碱,书写电离方程式;
② 根据酸碱抑制水的电离,盐类水解促进水的电离判断;
③ c点为HA和NaA物质的量1:1的溶液;
(3)利用电荷守恒和物料守恒计算;
(1)①已知25℃时,①HCOOH( aq) +OH ( aq)=HCOO(aq) +H2O(l) △H=a kJ/mol ②H+(aq) +OH(aq) =H2O(l) △H=b kJ/mol ①-②得到甲酸电离的热化学方程式HCOOH(aq)![]() HCOO(aq)+H+(aq) △H=( b a)kJ/mol;
HCOO(aq)+H+(aq) △H=( b a)kJ/mol;
正确答案:HCOOH(aq)![]() HCOO(aq)+H+(aq) △H=( b a)kJ/mol。
HCOO(aq)+H+(aq) △H=( b a)kJ/mol。
②根据电离常数可知酸性HCOOH>H2CO3>HCN,所以PH最大的是HCN,稀释相同倍数PH变化最大的是HCOOH;
正确答案: HCN HCOOH
③要想使溶液呈中性,酸性越弱所需体积越小,根据电离常数可知HCOOH酸性强于HCN,所以取等浓度、等体积HCOOH和HCN溶液,加入同浓度的NaOH溶液中和,当溶液呈中性时消耗NaOH溶液的体积:V (HCOOH)> V (HCN);
正确答案:>
④根据电离常数可知H2CO3酸性大于HCN,盐类越弱越水解的原理比较离子浓度,则0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN)<c(HCO3 );
正确答案:<
⑤根据电离常数可知HCOOH>HCN>HCO3-,盐类水解是越弱水解能力越强,达到相同PH需要浓度越小,所以常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是abc;
正确答案: abc
⑥根据电离常数可知酸性H2CO3>HCN>HCO3-,强酸之弱酸原理书写离子方程式CN+CO2+H2O=HCN+HCO3;
正确答案:CN+CO2+H2O=HCN+HCO3
⑦根据电离常数可知氨水电离常数大于碳酸和碳酸氢根离子,所以碳酸根离子水解能力强于铵根离子;若NH3·H2O与CO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”)。向该溶液中通入CO2气体可使溶液呈中性。此时溶液中c(NH4+)/c(CO3 2) >2;
正确答案:碱性 CO2 >
(2)① 根据b点溶液显碱性可以判断生成了强酸弱碱盐,所以HA为弱碱,书写电离方程式HA![]() H++ A;
H++ A;
正确答案:HA![]() H++ A
H++ A
② a点:HA溶液;b点:NaA溶液;c点:NaA和HA物质的量比为1:1的混合溶液;根据酸碱抑制水的电离,盐类水解促进水的电离判断b处溶液中水的电离程度最大;
正确答案:b。
③ c点为HA和NaA物质的量1:1的溶液,c点偏酸性说明HA的电离程度大于A-的水解程度,c点所示的溶液中除水分子外的微粒浓度由大到小的顺序依次为c(A)>c(Na+)> c(HA)>
正确答案:c(A)>c(Na+)> c(HA)>c(H+)>c(OH)
(3)电荷守恒式:C(Na+)+C(H+)=C(OH-)+C(A-)因为溶液呈中性所以C(Na+)= C(A-)=0.1/2=0.05mol/L;物料守恒C(HA)=n/2-0.05 mol/L,C(H+)=1×10-7 mol/L;
Ka=![]() =10-8/(n-0.1)
=10-8/(n-0.1)
正确答案:10-8/(n-0.1)


科目:高中化学 来源: 题型:
【题目】高铁酸钾的生产流程如图,涉及的离子反应方程式书写错误的是( )
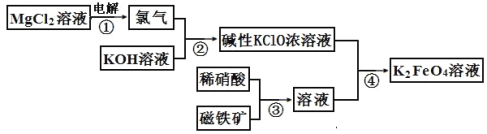
A. 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. Cl2+2OH-=Cl-+ClO-+H2O
C. 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
D. 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 0.1 mol/L 的CH3COOH 溶液加水稀释或加热均可使CH3COO-的物质的量增多
B. 0.1 mol/L 的CH3COOH 溶液加水稀释,c(CH3COO-)/[c(CH3COOH) ·c(OH-)]不变
C. 向0.1 mol/L CH3COOH溶液中加入少量纯醋酸,平衡向右移动,电离程度增大
D. 0.1 mol/L CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O42H2O工艺流程如下
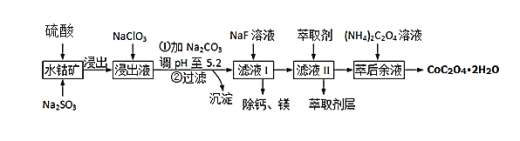
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
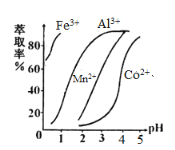
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________;其使用的适宜pH范围是_____.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______.
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O42H2O,最终得到产品 m2 kg,产率为________________。(不要求得出计算结果,只需列出数字计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3与NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
(一)提供的装置
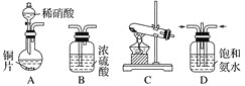

(二)NH3的制取
(1)下列有关实验室制备气体的说法正确的是__________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管
(2)从所提供的装置中选取一个能制取氨气的装置:________________(填序号)。
(3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是___________。
(三)模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
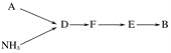
(4)A中反应的离子方程式为___________。
(5)D装置中的液体可换成________(填序号)。
a CuSO4 b H2O c CCl4 d 浓硫酸
(6)该同学所设计的模拟尾气处理实验还存在的明显缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molN2与3molH2反应生成的NH3分子数为2NA
B.14g乙烯(C2H4)和丙烯(C3H6)混合气体中的原子总数为3NA
C.1molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A. 该温度下,BaSO4的Ksp=8×10﹣10 B. M点和P点对应的Ksp相等
C. N点无BaSO4沉淀生成 D. 加入Na2SO4可以使溶液由Q点变到P点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com