
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。
【答案】 S2->Na+>Al3+ 第二周期第IVA族 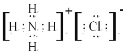 Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O ![]() HF HF分子间有氢键 CH4+10OH--8e-=CO3 -+7H2O
HF HF分子间有氢键 CH4+10OH--8e-=CO3 -+7H2O
【解析】由元素在周期表中位置,可以知道①为H、②为C、③为N、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br。根据元素的元素周期律进行解答。
(1)元素⑤为Na、⑥为Al、简单离子电子层数相同均为2个电子层,核外电子排布相同的微粒,核电荷数越大半径约小,所以Na+>Al3+,⑦为S简单离子为3个电子层所以微粒半径大小为:S2->Na+>Al3+;②为C核电荷数为6,,在元素周期表位置为第二周期第IVA族;③为N,简单氢化物NH3,⑧为Cl其氢化物为HCl混合形成的化合物为NH4Cl,属于离子化合物,电子式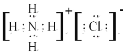 。
。
(2)⑤为Na其最高价氧化物水合物为NaOH, ⑥为Al的最高价氧化物为Al2O3,NaOH,和Al2O3反应的离子方程式Al2O3+2OH-=2AlO2-+H2O。
(3)元素①为H,⑧为Cl,两者形成的化合物为HCl属于共价化合物,其形成过程电子式为:![]() 。
。
(4)④为F、⑧为Cl、⑩为Br他们的氢化物分别为HF、HCl、HBr,根据元素周期律知F、Cl、Br的非金属性逐渐减弱,但HF分子间能形成氢键,所以沸点最高的是HF,答案:HF ;HF分子间有氢键。
5)由②为C和①为H组成最简单物质为CH4,,与O2组成燃料电池,电解质为KOH的水溶液CH4做负极,其电极反应式为CH4+10OH--8e-=CO3-+7H2O。


科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的简化电子排布式为____________________。
(2)实验室可用KSCN、苯酚( )来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为 _______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为_________。
)来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为 _______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为_________。
(3)FeCl3的熔点为306 ℃,沸点为315 ℃。FeCl3的晶体类型是_____________ 。FeSO4常作净水剂和补铁剂,SO42- 的立体构型是___________________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含______molσ键,与CO互为等电子体的离子是 _________________(填化学式,写一种)。
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg/cm3 ,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为 ________ ;Fe2+与O2-最短核间距为 __________ pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水的电离平衡,下列叙述正确的是
A. 将水加热,pH不变
B. 向水中滴入稀醋酸,c(H+)增大
C. 恒温下,向水中加入少量硫酸,Kw增大
D. 向水中加入少量醋酸铵固体,水的电离程度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法制取氢气,反应速率最大的是( )
A.冬天,块状锌与2 molL﹣1硫酸溶液反应
B.冬天,粉末状锌与2 molL﹣1硫酸溶液反应
C.夏天,块状锌与2 molL﹣1硫酸溶液反应
D.夏天,粉末状锌与2molL﹣1硫酸溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25molL﹣1min﹣1,下列说法正确的是( )
A. 该反应方程式中,x=1
B. 2min时,A的转化率为50%
C. 2min时,A的物质的量为0.75mol
D. 反应速率v(B)=0.25 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
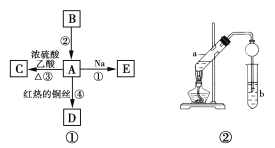
(1)写出B的结构简式__________,A中官能团的名称为__________。
(2)反应②和④的反应类型分别是__________、__________。
(3)写出下列反应的化学方程式:反应①__________,反应④__________。
(4)实验室利用反应③制取C,常用上图②装置:
①a试管中的主要化学反应的方程式为__________。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是__________。
③试管b中液体作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,其开发利用的部分流程如图所示。下列说法错误的是

①试剂1可以选用NaOH溶液
②从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2=2Cl-+Br2
③工业上,电解熔融MgO冶炼金属镁可减小能耗
④制铝:工业上电解熔融氯化铝来制备铝
⑤制钠:电解饱和NaCl溶液来制备钠
⑥炼铁:用CO在高温下还原铁矿石中的铁
A. ①③④⑥ B. ②③④⑥ C. ①②③⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件).
(2)探究反应条件对0.10mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,密闭容器中的反应N2+3H2![]() 2NH3,达到化学平衡状态的标志是
2NH3,达到化学平衡状态的标志是
A. 单位时间内消耗1 mol N2,同时生成2 mol NH3
B. 容器内三种气体物质的量比为n(N2):n(H2):n(NH3)=1:3:2
C. 断裂1molH-H键同时生成2molN-H键
D. 容器中各组分的物质的量分数不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com