
【题目】关于水的电离平衡,下列叙述正确的是
A. 将水加热,pH不变
B. 向水中滴入稀醋酸,c(H+)增大
C. 恒温下,向水中加入少量硫酸,Kw增大
D. 向水中加入少量醋酸铵固体,水的电离程度不变
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是S02在400~600℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是 ( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是 ( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 达到平衡时,SO2的浓度与SO3的浓度相等
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 在上述条件下,SO2不可能100%的转化为SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 可用新制的Cu(OH)2悬浊液鉴别乙酸溶液、蔗糖溶液、葡萄糖溶液
B. 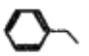 中所有碳原子一定处于同一平面
中所有碳原子一定处于同一平面
C. 苯乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键
D. 有机物(C4H10)的一溴代物有六种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉、唾液淀粉酶和控制合成唾液淀粉酶的DNA,它们的基本组成单位依次是 ( )
A. 葡萄糖、葡萄糖和氨基酸 B. 葡萄糖、氨基酸和脱氧核苷酸
C. 麦芽糖、氨基酸和核糖核苷 D. 葡萄糖、氨基酸和核糖核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石(Na3AlF6)微溶于水。冰晶石主要用作冶炼金属铝的助熔剂,也可用作农作物杀虫剂、制造乳白色玻璃和搪瓷的遮光剂等。工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:

(1)Na3AlF6中Al的化合价为__________,滤渣A的主要成分是__________(填化学式)。
(2)为了提高浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③__________。
(3)根据下表数据,选择“酸浸”时最适合的条件为__________。
实验编号 | 萤石品位 | 硫酸浓度 | 反应温度/℃ | 获得Na2SiF6的质量/g |
1 | 96% | 25% | 60-70 | 120 |
2 | 96% | 35% | 60-70 | 153 |
3 | 96% | 35% | 80-90 | 100 |
4 | 96% | 40% | 60-70 | 141 |
(4)写出反应③的化学方程式__________。
(5)电解熔融Al2O3冶炼铝,化学方程式为![]() ,下图表示一定质量的Al2O3和Na3AlF6固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是__________。
,下图表示一定质量的Al2O3和Na3AlF6固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是__________。

A.生成O2的速率 B.固体中Na3AlF6的质量
C.固体中氧元素的质量 D.固体中铝元素的质量分数
(6)此生产工艺的优点为__________(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣Q1 kJmol﹣1
2H2(g)+O2(g)═2H2O(g);△=﹣Q2 kJmol﹣1 ,
2H2(g)+O2(g)═2H2O(l);△H2=﹣Q3 kJmol﹣1
常温下,取体积比2:3的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2
B.0.2Q1+0.05Q2
C.0.2Q1+0.15Q3
D.0.2Q1+0.3Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。

下列叙述不正确的是
A. 膜a、膜c分别是阴离子交换膜、阳离子交换膜
B. 阳极室、阴极室的产品分别是氢氧化钠、硝酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 该装置工作时,电路中每转移0.2 mol 电子,两极共生成气体3.36L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用如图所示的装置进行制取NO实验(已知Cu与HNO3的反应是放热反应)。

(1)在检查装置的气密性后,向试管a中加入10mL6mol/L稀HNO3和lgCu片,然后立即用带导管的橡皮塞塞紧试管口。请写出Cu与稀HNO3反应的化学方程式:_________。
(2)实验过程中通常在开始反应时反应速率缓慢,随后逐渐加快,这是由于_________,进行一段时间后速率又逐渐减慢,原因是_________。
(3)欲较快地制得NO,可采取的措施是_________。
A.加热 B.使用铜粉 C.稀释HNO3 D.改用浓HNO3
II.为了探究几种气态氧化物的性质,某同学设计了以下实验:
用三只集气瓶收集满二氧化硫、二氧化氮气体。倒置在水槽中,然后分别缓慢通入适量氧气或氯气,如图所示。一段时间后,A、B装置中集气瓶中充满溶液,C装置中集气瓶里还有气体。

(1)写出C水槽中反应的化学方程式:____________。
(2)写出B水槽里发生氧化还原反应的离子方程式: ____________。
(3)如果装置A中通入的氧气恰好使液体充满集气瓶,假设瓶内液体不扩散,气体摩尔体积为aL/mol,集气瓶中溶液的物质的量浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com