
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 0.1 mol/L 的CH3COOH 溶液加水稀释或加热均可使CH3COO-的物质的量增多
B. 0.1 mol/L 的CH3COOH 溶液加水稀释,c(CH3COO-)/[c(CH3COOH) ·c(OH-)]不变
C. 向0.1 mol/L CH3COOH溶液中加入少量纯醋酸,平衡向右移动,电离程度增大
D. 0.1 mol/L CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-)的值减小
【答案】C
【解析】
A.0.1 mol/L 的CH3COOH 溶液加水稀释或加热,平衡正向移动,均可使CH3COO-的物质的量增多,故不选A。
B.0.1 mol/L 的CH3COOH 溶液加水稀释,c(CH3COO-)/[c(CH3COOH) ·c(OH-)]=Ka/Kw,只受温度影响,加水稀释不发生变化,故不选B;
C.向0.1 mol/L CH3COOH溶液中加入少量纯醋酸,平衡向右移动,电离程度减小,故选C;
D.0.1 mol/L CH3COOH溶液加水稀释,平衡正向移动,溶液中c(CH3COOH)/c(CH3COO-)= n(CH3COOH)/n(CH3COO-)的值减小,故不选D;
正确答案:C。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应X(g)+2Y(g) ![]() 2Z(g)。下列叙述能判断该反应达到化学平衡的是
2Z(g)。下列叙述能判断该反应达到化学平衡的是
① X、Y、Z的物质的量之比是1∶2∶2 ② X、Y、Z的浓度不再发生变化③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时消耗n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是( )
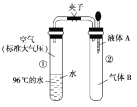
A.高锰酸钾溶液、甲烷B.盐酸、氨气
C.氢氧化钠溶液、二氧化碳D.石灰水、二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝在工业生产中有多种用途。请根据信息回答:
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
己知:2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351 kJ·mol-1
2C(s)+O2 (g)=2CO(g); △H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s) △H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为_____。
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H4。
CH4(g)+2H2O(g) △H4。
常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数![]() ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。
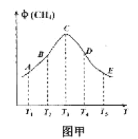
①A、B、C、D、E五点中,尚未达到平衡的点是___,该反应的△H4__0(填“>”或“<”)。
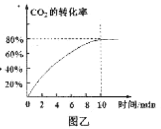
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=___;平衡常数为____
(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。
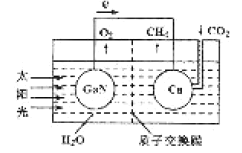
①写山铜电极表面的电极反应式____。
②为提高该人工光合系统的工作效率,可向装置中加入少量__(选填“盐酸”或“硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
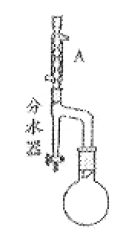
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。
分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05 g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79 g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95 g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是___。
(2)步骤2中,图中所示装置中仪器A的名称是___,其作用为___。
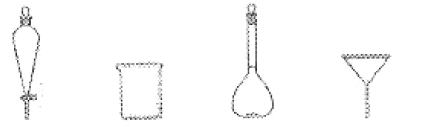
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是___;分离有机相的操作名称为__,分离有机相时不需要用到下列玻璃仪器中的__ (填名称)。
(4)实验中可能生成的有机副产物结构简式为____ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为___%。实际产率低于理论值的原因有多种,下列所述原因中不可能的是___ (填字母)。
a.分水器收集的水里含丙烯酸甲酯 b.本实验条件下发生了副反应
c.产品在洗涤、蒸发过程中有损失 d.产品精制时收集部分低沸点物质
(6)本实验中需要采取的安全防护措施有____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 已知HI(g) ![]() 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C. 已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡等,请回答下列问题。
(1)已知部分弱电解质的电离常数如下表:
弱电解质 | NH3.H2O | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Kb = 1.8×10 5 | Ka = 1. 77×10 4 | Ka=4.3×1010 | Ka1=5.0×107 Ka2=5.6×1011 |
① 已知25℃时,HCOOH( aq) +OH ( aq)=HCOO(aq) +H2O(l) △H=a kJ/mol H+(aq) +OH(aq) =H2O(l) △H=b kJ/mol 甲酸电离的热化学方程式为______________。
②取浓度相同的上述三种酸溶液,溶液pH最大的是_________,稀释相同的倍数后,溶液pH变化最大的是____________________。
③分别取等浓度、等体积HCOOH和HCN溶液,加入同浓度的NaOH溶液中和,当溶液呈中性时消耗NaOH溶液的体积:V (HCOOH)______ V (HCN) (填“>”、“<”或“=”)。
④0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN)______c(HCO3 )(填“>”、“<”或“=”)。
⑤常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是_____________(填编号)。
⑥将少量CO2通入NaCN溶液,反应的离子方程式是__________________________________。
⑦若NH3·H2O与CO2恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。向该溶液中通入________气体可使溶液呈中性(填“CO2”或“NH3”)。此时溶液中c(NH4+)/c(CO3 2) ________2(填“>”“<”或“=”)
(2)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

① HA的电离方程式是____________________________
② a、b、c处溶液中水的电离程度最大的是_______________
③ c点所示的溶液中除水分子外的微粒浓度由大到小的顺序依次为______________________________。
(3)常温下,将等体积0.1 molL-1NaOH和n molL-1HA混合,溶液呈中性,该温度下HA的电离常数Ka=___________(用含有n的式子表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com