
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是( )
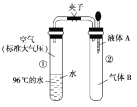
A.高锰酸钾溶液、甲烷B.盐酸、氨气
C.氢氧化钠溶液、二氧化碳D.石灰水、二氧化硫
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾的生产流程如图,涉及的离子反应方程式书写错误的是( )
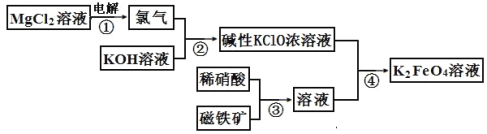
A. 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. Cl2+2OH-=Cl-+ClO-+H2O
C. 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
D. 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:(填“加快”、“不变”或“减慢”)。
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:(填“加快”、“不变”或“减慢”)。
①保持体积不变充入Ne,其反应速率___。
②保持压强不变充入Ne,其反应速率____。
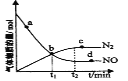
(2)在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为__(选填字母)。
5N2(g)+6H2O(g)。某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为__(选填字母)。
(3)一定条件下,在2L密闭容器内,发生反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用NO2表示0~2s内该反应的平均速率为___。
②在第5s时,NO2的转化率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知![]()
![]() ,则
,则![]() 固体与稀盐酸完全反应,放出的热量即为
固体与稀盐酸完全反应,放出的热量即为![]()
B. 已知![]()
![]()
![]()
![]() 则
则![]()
C. 已知![]() ,则反应物总能量小于生成物总能量
,则反应物总能量小于生成物总能量
D. 已知![]() (白磷,s)=
(白磷,s)=![]() (红磷,s)
(红磷,s)![]() ,则白磷比红磷稳定
,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种化合物,许多含硫化合物在工业上有重要的用途。
(1)硫化钠(Na2S)俗称硫化碱,常用于印染及制药工业。将硫化钠溶于水,会导致水的电离程度____(该“增大”、“减小”威“不变”);若微热该溶液,pH会___(填“增大”、“减小”或“不变”)。
(2)硫氢化钠(NaHS)常用作有机合成的中间体,其水溶液呈碱性。NaHS溶液中Na+、H+、HS-,OH-离子浓度由大到小的顺序为____。
(3)若向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,可发生以下反应:
Na2S+Na2SO3+H2SO4→Na2SO4+S↓+H2O(未配平)
①配平化学方程式:__Na2S+__Na2SO3+__H2SO4=__Na2SO4+__S↓+__H2O
②反应中还原产物与氧化产物的物质的量之比是__
(4)室温时,已知H2S的Ka1=1×10-7,Ka2=1×10-13,若只考虑S2-的第一步水解,则 0.1 mol·L-1Na2S溶液pH约__
(5)化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+,其反应原理为:Cu2+(aq)+FeS(s)![]() CuS(s)+Fe2+(aq)。下列有关叙述中正确的是___
CuS(s)+Fe2+(aq)。下列有关叙述中正确的是___
a.Ksp(FeS)<Ksp(CuS)
b.达到平衡时c(Fe2+)=c(Cu2+)
c.溶液中加入少量Na2S固体后,溶液中c(Fe2+)、c(Cu2+)都减小
d.该反应平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 0.1 mol/L 的CH3COOH 溶液加水稀释或加热均可使CH3COO-的物质的量增多
B. 0.1 mol/L 的CH3COOH 溶液加水稀释,c(CH3COO-)/[c(CH3COOH) ·c(OH-)]不变
C. 向0.1 mol/L CH3COOH溶液中加入少量纯醋酸,平衡向右移动,电离程度增大
D. 0.1 mol/L CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molN2与3molH2反应生成的NH3分子数为2NA
B.14g乙烯(C2H4)和丙烯(C3H6)混合气体中的原子总数为3NA
C.1molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com