
【题目】某温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A. 该温度下,BaSO4的Ksp=8×10﹣10 B. M点和P点对应的Ksp相等
C. N点无BaSO4沉淀生成 D. 加入Na2SO4可以使溶液由Q点变到P点
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡等,请回答下列问题。
(1)已知部分弱电解质的电离常数如下表:
弱电解质 | NH3.H2O | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Kb = 1.8×10 5 | Ka = 1. 77×10 4 | Ka=4.3×1010 | Ka1=5.0×107 Ka2=5.6×1011 |
① 已知25℃时,HCOOH( aq) +OH ( aq)=HCOO(aq) +H2O(l) △H=a kJ/mol H+(aq) +OH(aq) =H2O(l) △H=b kJ/mol 甲酸电离的热化学方程式为______________。
②取浓度相同的上述三种酸溶液,溶液pH最大的是_________,稀释相同的倍数后,溶液pH变化最大的是____________________。
③分别取等浓度、等体积HCOOH和HCN溶液,加入同浓度的NaOH溶液中和,当溶液呈中性时消耗NaOH溶液的体积:V (HCOOH)______ V (HCN) (填“>”、“<”或“=”)。
④0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN)______c(HCO3 )(填“>”、“<”或“=”)。
⑤常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是_____________(填编号)。
⑥将少量CO2通入NaCN溶液,反应的离子方程式是__________________________________。
⑦若NH3·H2O与CO2恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。向该溶液中通入________气体可使溶液呈中性(填“CO2”或“NH3”)。此时溶液中c(NH4+)/c(CO3 2) ________2(填“>”“<”或“=”)
(2)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

① HA的电离方程式是____________________________
② a、b、c处溶液中水的电离程度最大的是_______________
③ c点所示的溶液中除水分子外的微粒浓度由大到小的顺序依次为______________________________。
(3)常温下,将等体积0.1 molL-1NaOH和n molL-1HA混合,溶液呈中性,该温度下HA的电离常数Ka=___________(用含有n的式子表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 用新制Cu(OH)2悬浊液检验牙膏中的甘油时,可生成绛蓝色沉淀
B. 用纸层析法分离Cu2+和Fe3+,为了看到色斑,必须通过氨熏
C. 氯化钻浓溶液加水稀释,溶液的颜色由蓝色逐渐转变为粉红色
D. 摘下几根火柴头,浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液和稀硝酸,若出现白色沉淀,说明火柴头中含氯元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业食盐中含Ca2+、Mg2+等杂质,某厂电解饱和食盐水制取NaOH溶液的工艺流程如图所示,回答下列问题:
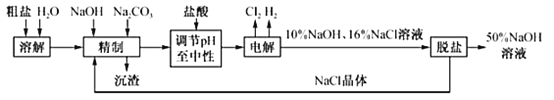
(1)“精制”过程中发生反应的离子方程式为_____
(2)若粗盐中SO42﹣含量也较高,沉淀剂可以是_____(填字母)且要在试剂Na2CO3之_____加入(填“前”或“后”)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)在电解过程中,产生H2的电极与外接电源的_____极相连;溶液pH增大的区域是_____(填“阳极区”或“阴极区”)。
(4)烧碱和氯气是电解饱和食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_____(填写计算表达式和结果且结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3︰4,M原子的最外层电子数与次外层电子数之比为3︰4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻。请回答下列问题。
(1)M在元素周期表中的位置是___,写出Z的离子结构示意图:__;Q的简单氢化物的结构式为___。
(2)写出X、Y、R按原子个数之比1︰1︰1形成的化合物的化学式:___。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:___。
(4)写出单质R的一种工业用途:___。
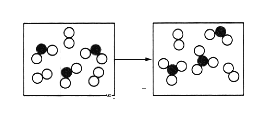
(5)如图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式:___。
(6)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣的数目为 NA
B.0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
C.标准状况下,22.4LH2O含有的分子数为NA
D.一定条件下2.3gNa与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若一个氖原子质量是a g,一个12C原子质量是b g,设阿伏加德罗常数的数值为NA,下列说法不正确的是 ( )
A. 该氖原子的相对原子质量是12a/bB. 该氖原子的摩尔质量是aNAg
C. Wg该氖原子的物质的量是![]() molD. Wg该氖原子所含质子数是10W/a
molD. Wg该氖原子所含质子数是10W/a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com