
【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。
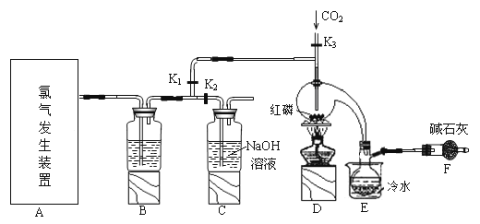
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ |
PCl3 | 137.5 | -112 | 75.5 |
POCl3 | 153.5 | 2 | 105.3 |
请回答下列问题:
(1)请从下图中选择制备氯气的发生装置
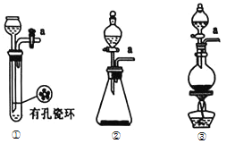
你选用的装置是____(填序号),反应的离子方程式为____。
(2)B中所盛试剂是_____。
(3)E中冷水的作用是____。
(4)仪器F的名称是____;F中碱石灰的作用是___。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过__(填操作名称)即可得到较纯净的PCl3。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/LNa2S2O3溶液8.00mL。
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为___(保留3位有效数字)。
【答案】②或③ 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O或MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 浓硫酸 冷却PCl3,防止挥发 球形干燥管 吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应 蒸馏 82.5%
Mn2++Cl2↑+2H2O 浓硫酸 冷却PCl3,防止挥发 球形干燥管 吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应 蒸馏 82.5%
【解析】
实验室要用红磷与干燥的氯气模拟工业生产制取PCl3流程为:利用②或③装置制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,利用二氧化碳排尽装置中的空气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的氯气,防止空气中的水蒸气进入烧瓶和PCl3反应。
(1)实验室制备氯气时,用二氧化锰与浓盐酸共热或高锰酸钾与浓盐酸反应,选择制备氯气的发生装置为②、③;反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O或MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)PCl3遇水会强烈水解,需要干燥的氯气,则B装置中试剂为浓硫酸;
(3)PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝);
(4)根据装置特点,F装置为球形干燥管,尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,碱石灰可吸收多余的氯气,防止空气中的水蒸气进入烧瓶和PCl3反应;
(5)POCl3的沸点为105.3℃,PCl3的沸点为75.5℃,且互相溶解,可利用蒸馏方式分离;
(6)根据题给信息可知:滴定实验涉及关系式为PCl3—H3PO3—I2和2Na2S2O3--I2,设混合物中PCl3的物质的量为nmol,水解生成的H3PO3反应掉的I2的物质的量为nmol;滴定多余I2的消耗的Na2S2O3的物质的量为0.1×8.40×10-3=8.4×10-4mol,多余的I2的物质的量为0.0008/2=0.0004mol,提供I2的总物质的量0.1×10×10-3mol,H3PO3反应掉的I2的物质的量: 1×10-3-0.0004=0.0006 mol,25.00mL溶液里含有PCl3的质量为0.0006×137.5=0.0825g,则250mL溶液中,含有PCl3的质量为0.825 g,产品中PCl3的质量分数为0.825/1×100%=82.5%。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知![]()
![]() ,则
,则![]() 固体与稀盐酸完全反应,放出的热量即为
固体与稀盐酸完全反应,放出的热量即为![]()
B. 已知![]()
![]()
![]()
![]() 则
则![]()
C. 已知![]() ,则反应物总能量小于生成物总能量
,则反应物总能量小于生成物总能量
D. 已知![]() (白磷,s)=
(白磷,s)=![]() (红磷,s)
(红磷,s)![]() ,则白磷比红磷稳定
,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3与NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
(一)提供的装置
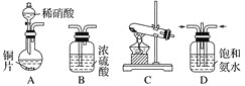

(二)NH3的制取
(1)下列有关实验室制备气体的说法正确的是__________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管
(2)从所提供的装置中选取一个能制取氨气的装置:________________(填序号)。
(3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是___________。
(三)模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
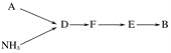
(4)A中反应的离子方程式为___________。
(5)D装置中的液体可换成________(填序号)。
a CuSO4 b H2O c CCl4 d 浓硫酸
(6)该同学所设计的模拟尾气处理实验还存在的明显缺陷是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取一些重要的化工产品的工艺流程如图所示。
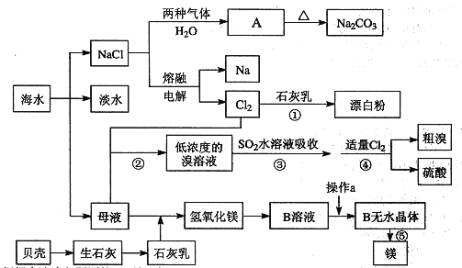
根据上述流程图回答下列问题:
(1)图中A的化学式为 ___________,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为________________。
(2)海水淡化处理的方法有_____________________。(写出2种即可)
(3)过程⑤的化学方程式为 _________________________________。
(4)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式________________________________。
(5)过程②到过程④的变化为“Br→Br2→Br→Br2”,其目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molN2与3molH2反应生成的NH3分子数为2NA
B.14g乙烯(C2H4)和丙烯(C3H6)混合气体中的原子总数为3NA
C.1molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是
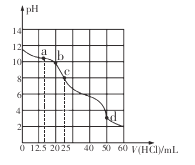
A. a点:c( HCO3-)>c(Cl-)>c(C032-)
B. b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH-)
C. c点:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D. d点:c(Cl-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化碳是一种灰白色粉末,熔点为94~95℃,广泛用于有机化合物的溴代、农药的制备等。某合作学习小组的同学拟用丙酮和液溴制备四溴化碳,其原理为CH3COCH3+4Br2+5NaOH→CBr4+CH3COONa+4NaBr+4H2O。回答下列问题:
Ⅰ.制取Br2
(1)甲组同学拟用溴化钠、二氧化锰及浓硫酸制备液溴,其实验装置如图1所示:
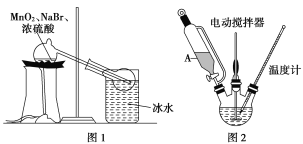
①该装置不用橡皮塞及橡皮管,其原因是___________________;
②冰水的作用是__________________________。
Ⅱ.制取CBr4
(2)乙组同学拟利用甲组同学制得的液溴与CH3COCH3(沸点56.5℃)等试剂制取四溴化碳。实验步骤如下:
步骤1:向图2中三颈烧瓶中加入11.4 g NaOH和46 mL水,搅拌。
步骤2:冰水浴冷却至2℃时,开始不断滴加液溴20 g,滴加完毕后在5℃下保持20 min。
步骤3:加入少量相转移试剂,在不断搅拌下滴入1.6 g丙酮,维持温度在5~10℃,连续搅拌4 h。
步骤4:过滤、冷水洗涤、减压烘干,得产品8.3 g。
①步骤2滴入Br2之前,冷却至2℃的目的是__________________________
②步骤4洗涤时,如何证明已洗涤干净: ___________________________。
③本次实验中产品的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理是研究和学习化学的重要依据。回答下列问题:
(1)已知氢气的燃烧热△H=﹣285.5kJmol﹣1,则电解水的热化学方程式为_____
(2)在298K、101kPa下,2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1,则相同条件下,2mol SO2和 1 mol O2充分反应,最终放出的热量_____198kJ(填“大于”“小于或“等于”);该反应的平衡常数表达式K=_____。
(3)25℃时,下表为一些难溶电解质的相关数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 5.8 | 4.1 | 2.0 |
完全沉淀时的pH | 8.3 | 6.4 | 3.2 |
常温下,除去酸性CuCl2溶液中含有的少量FeCl2,其操作步骤为:
①应先加入_____(填试剂名称),发生的离子反应方程式为_____
②再加入CuO,调节溶液的pH在_____范围内,使溶液中的Fe3+转化为Fe(OH)3沉淀,过滤。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com