
【题目】下表为短周期元素,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)

(1)上述元素中金属性最强和非金属性最强的元素名称分别是___、___;
(2)①和②的气态氢化物稳定性较强的是(写化学式):___;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为___;写出⑤单质与③的最高价氧化物对应水化物反应的化学方程式为___。描述H2在⑧单质中燃烧的现象___。
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是___;
(5)比较②和③对应简单离子的离子半径较小的是(用相应离子符号表示)___。
(6)写出③的最高价氧化物对应水化物的电子式___;其含有的化学键类型是___。
【答案】钠 氟 HF HClO4 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 安静的燃烧,发出苍白色火焰,出现白雾 第三周期VIIA族 Na+ ![]() 离子键、极性键
离子键、极性键
【解析】
由元素在周期表中的位置,可确定①~⑨号元素分别为N、F、Na、Mg、Al、Si、P、Cl、Ar。
(1)依据同周期元素从左往右金属性依次减弱,非金属性依次增强,可推得上述元素中金属性最强和非金属性最强的元素名称分别是钠、氟。答案为:钠;氟;
(2)①和②分别为N和F,非金属性N<F,气态氢化物稳定性较强的是HF。答案为:HF;
(3)在上述元素中,氯的最高价氧化物对应水化物酸性最强,此酸化学式为HClO4;⑤单质Al与③的最高价氧化物对应水化物NaOH反应,生成NaAlO2和H2,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。描述H2在⑧单质Cl2中燃烧的现象为安静的燃烧,发出苍白色火焰,出现白雾。答案为:HClO4;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;安静的燃烧,发出苍白色火焰,出现白雾;
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,则该元素为氯,其电子排布为2、8、6,在周期表中的位置是第三周期VIIA族。答案为:第三周期VIIA族;
(5)②和③对应简单离子为F-、Na+,二者的电子层结构相同,但Na的核电荷数比F大,所以离子半径较小的是Na+。答案为:Na+;
(6)③的最高价氧化物对应水化物为NaOH,电子式为![]() ;其含有的化学键类型是离子键、极性键。答案为:
;其含有的化学键类型是离子键、极性键。答案为:![]() ;离子键、极性键。
;离子键、极性键。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是从元素周期表中截取下来的,甲、乙、丙为短周期主族元素,下列说法中正确的是( )
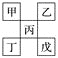
A. 丁一定是金属元素,其金属性比丙强
B. 丙的最高价氧化物水化物显强酸性
C. 乙的氢化物是以分子形式存在,且分子间存在氢键
D. 戊的原子序数一定是甲的5倍,且原子半径比甲大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态,其电路工作原理如图所示。下列说法中正确的是
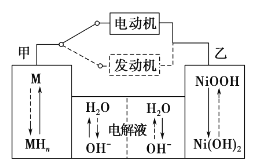
A. 放电时甲为负极,充电时为阳极
B. 电池充电时,OH—由甲侧向乙侧移动
C. 放电时负极的电极反应式为:MHn—ne—=M+nH+
D. 汽车下坡时发生图中实线所示的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不能说明CO2是酸性氧化物的是( )
A.Na2CO3+H2SO4═CO2↑+H2O+Na2SO4
B.CO2+2NaOH═Na2CO3+H2O
C.CO2+2Mg![]() 2MgO+C
2MgO+C
D.CO2+Na2O=Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO3分解反应为2SO3(g)2SO2(g)+O2(g)。在1.0L密闭容器中加入10mol SO3(g),在一定温度进行上述反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/kPa | 400 | 412 | 422 | 440 | 469 | 518 | 538 | 560 | 560 |
回答下列问题:
(1)欲提高SO3的平衡转化率,应采取的措施为_____(填字母)。
a.增大压强 b.通入SO3 c.降低压强
(2)平衡时SO3的转化率为_____,该温度下的平衡常数Kw=_____
(3)研究表明,SO3(g)分解速率v=4×10﹣3×pSO3(kPamin﹣1),t=6h时,测得体系中pO2=55kPa,则此时的pSO3=_____kPa,v(SO3)=_____kPamin﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三苯甲醇是有机合成中间体。实验室用格氏试剂![]() )与二苯酮反应制备三苯甲醇。已知:①格氏试剂非常活泼,易与水、氧气、二氧化碳等物质反应;
)与二苯酮反应制备三苯甲醇。已知:①格氏试剂非常活泼,易与水、氧气、二氧化碳等物质反应;
②![]()
③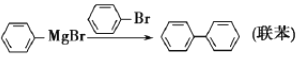
④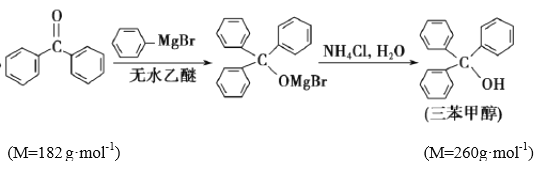
实验过程如下
①实验装置如图1所示。
a.合成格氏试剂:向三颈烧瓶中加入0.75g镁屑和少量碘(引发剂),连接好装置,在恒压漏斗中加入3.20mL(0.03mol)溴苯和15.00mL乙醚混匀,开始缓慢滴加混合液,滴完后待用。
b.制备三苯甲醇:将5.50g二苯与15.00mL乙醚在恒压漏斗中混匀,滴入三颈烧瓶。40℃左右水溶回流0.5h,加入20.00mL包和氯化铵溶液,使晶体析出。
②提纯:图2是简易水蒸气蒸馏装置,用该装置进行提纯,最后冷却抽滤
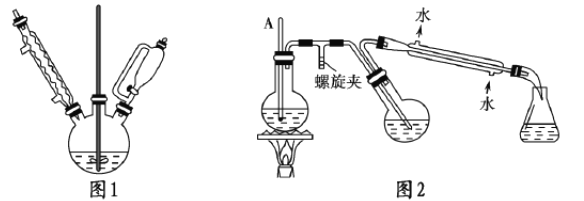
(1)图1实验中,实验装置有缺陷,应在球形冷凝管上连接____________装置
(2)①合成格氏试剂过程中,低沸点乙醚的作用是____________________;
②合成格氏试剂过程中,如果混合液滴加过快将导致格氏试剂产率下降,其原因是______;
(3)提纯过程中发现A中液面上升,此时应立即进行的操作是_______;
(4)①反应结束后获得三苯甲醇晶体的操作为_______、过滤、洗涤______;
A.蒸发结晶 B.冷却结晶 C.高温烘干 D.滤纸吸干
②下列抽滤操作或说法正确的是_______
A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
C.注意吸滤瓶内液面高度,当接近支管口位置时,拨掉橡皮管,滤液从支管口倒出
D.用抽滤洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物,以减少沉淀物损失
E.抽滤不宜用于过滤胶状成剧粒太小的沉淀
(5)用移液管量取20.00mL饱和氯化较溶液,吸取液体时,左手______,右手持移液管;
(6)通过称量得到产物4.00g,则本实验产率为__________(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室中常用排饱和食盐水的方法收集Cl2
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 升高温度能够促进水的电离
D. 在含有Fe(SCN)3的红色溶液中加少量铁粉,振荡静置,溶液颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com