
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)

(1)由E形成的物质中硬度最大的是___(填名称),属于___(填“晶体类型”)。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是___,该碱溶液与D的最高价氧化物反应的离子方程式___。
(3)常用作光导纤维的是___。
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序___。
(5)H、J、K的最高价氧化物对应水化物的酸性由强到弱的顺序___。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是___。
(7)元素I的氢化物的结构式为___;该氢化物常温下和元素K的单质反应的化学方程式为___。
【答案】金刚石 原子晶体 ![]() 2OH-+Al2O3=2AlO2-+H2O SiO2 H2O>NH3>PH3 HClO4>H2SO4>H3PO4 S2->Cl->O2- H—O—H Cl2+H2O
2OH-+Al2O3=2AlO2-+H2O SiO2 H2O>NH3>PH3 HClO4>H2SO4>H3PO4 S2->Cl->O2- H—O—H Cl2+H2O ![]() HClO+HCl
HClO+HCl
【解析】
根据元素周期表可知,A为氢元素,B为钠元素,C为镁元素,D为铝元素,E为碳元素,F为硅元素,G为氮元素,H为磷元素,I为氧元素,J为硫元素,K为氯元素,L为氩元素。
(1)E为碳元素,形成的物质中硬度最大的是金刚石,属于原子晶体,故答案为:金刚石;原子晶体;
(2)同周期元素从左到右,金属性逐渐减弱,同主族元素,从上到下,金属性逐渐增强,可知钠金属性最强,对应的碱为氢氧化钠,其电子式为![]() ,D为铝元素,其最高价氧化物为氧化铝,氧化铝有两性,与氢氧化钠反应的离子反应方程式为2OH-+Al2O3=2AlO2-+H2O,故答案为:
,D为铝元素,其最高价氧化物为氧化铝,氧化铝有两性,与氢氧化钠反应的离子反应方程式为2OH-+Al2O3=2AlO2-+H2O,故答案为:![]() ;2OH-+Al2O3=2AlO2-+H2O;
;2OH-+Al2O3=2AlO2-+H2O;
(3)二氧化硅常用作光导纤维,故答案为:SiO2;
(4)同周期元素从左到右非金属性逐渐增强,同主族元素从上到下非金属性逐渐减弱,则非金属性O>N>P,非金属性强的元素对应的氢化物越稳定,则稳定性H2O>NH3>PH3,故答案为:H2O>NH3>PH3;
(5)同周期元素从左到右非金属性逐渐增强,则非金属性Cl>S>P,非金属性强的元素对应的最高价含氧酸的酸性强,则酸性HClO4>H2SO4>H3PO4,故答案为:HClO4>H2SO4>H3PO4;
(6)S2-、Cl-均有三个电子层,核外电子排布相同,则核电荷数小的离子半径大,即S2->Cl-,O2- 有两个电子层,比S2-、Cl-的离子半径都小,则S2->Cl->O2-,故答案为:S2->Cl->O2-;
(7)元素I的氢化物为水,结构式为H—O—H,水在常温下和氯气反应的化学方程式为Cl2+H2O ![]() HClO+HCl,故答案为:H—O—H;Cl2+H2O
HClO+HCl,故答案为:H—O—H;Cl2+H2O ![]() HClO+HCl。
HClO+HCl。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1氨水中存在如下电离平衡:NH3·H2O ![]() NH4++OH-,对于该平衡,下列叙述正确的是
NH4++OH-,对于该平衡,下列叙述正确的是
A. 加入水时,溶液中c(OH-) 增大
B. 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小
C. 通入少量HCl气体,溶液中c(NH4+)增大
D. 降低温度,促进NH3·H2O电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Pb为第ⅣA元素。常见的化合价为+2和+4,其单质和化合物都有着广泛的用途。
己知Pb2+可以和EDTA|乙二胺四乙酸(HOOCCH2)2NCH2-CH2N(CH2COOH)2|形成无色的1:1的稳定络合物。
请回答下列问题:
(1)基态Pb原子价电子排布式为___
(2)碳、硅与铅同主族。碳纳米管可以制成透明导电的薄膜,其结构类似于石墨晶体,则多层碳纳米管的层与层之间靠___结合在一起。四卤化硅(SiX4)均是无机化工品,其沸点按F、Cl、Br、I依次升高的原因是____
(3)在EDTA中,碳原子的杂化方式有____、___。组成EDTA的四种元素中第一电离能最大的是____
(4)Pb(NO3)2中阴离子的立体构型是____,写出一个与该阴离子立体构型相同的分子的化学式___
(5)Sn与Pb同为第ⅣA元素。请用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角___120°(填“>” “<即或“=”)。
(6)Pb与Ti、O构成的晶体可用于制造复合电子陶瓷,该晶体的晶胞如图所示,其中Pb、Ti、O分别位于顶点、体心和面心,该晶体的化学式为___,若晶胞参数为a nm,则Pb与O间的最短距离为___nm,与Pb紧邻的O个数为___

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)![]() 4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
A.系数x >2
B.若增大该体系的压强,平衡向左移动,化学平衡常数变小
C.若增大该体系的压强,平衡向右移动,化学平衡常数不变
D.该反应的化学平衡常数表达式是K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)![]() 3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。

下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
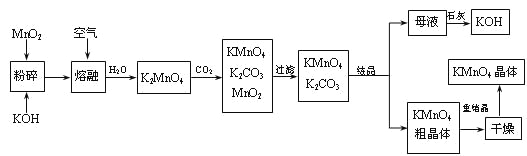
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 石油分馏可获得汽油、煤油、石蜡等矿物油,煤焦油干馏可获得苯、甲苯等有机物
B. 生活中常见的聚乙烯、聚氯乙烯、纶、有机玻璃、合成橡胶都是通过加聚反应得到的
C. 按系统命名法,有机物 可命名为2,2,4,4,5—五甲基—3,3—二乙基己烷
可命名为2,2,4,4,5—五甲基—3,3—二乙基己烷
D. 碳原子数≤6的链状单烯烃,与HBr反应的产物只有一种结构,符合条件的单烯烃有4种(不考虑顺反异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com