
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)![]() 3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。

下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】“502”胶水的主要成分为![]() ,下列说法错误的是( )
,下列说法错误的是( )
A. 该物质的分子式为C5H5NO2
B. 该物质难溶于水,易溶于苯等有机溶剂
C. 该物质可使酸性高锰酸钾溶液褪色
D. 该物质可经缩聚反应固化粘着
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为准确测定FeSO4的浓度,可用重铬酸钾标准溶液进行滴定。(已知重铬酸钾被还原为Cr3+)
步骤1.用分析天平准确称取2.9400g重铬酸钾,配制500mL重铬酸钾标准溶液;
步骤2.移取25.00mL所配制的重铬酸钾标准溶液于500mL锥形瓶中,用蒸馏水稀释至250mL,再加20mL浓硫酸,冷却后,加2~3滴试亚铁灵指示剂;
步骤3.用待测硫酸亚铁溶液滴定至溶液由橙黄到绿,由绿色刚变为红紫色为终点;
步骤4.记录消耗硫酸亚铁溶液的体积为18.70 mL。
(1)配制500mL重铬酸钾标准溶液需要的玻璃仪器有量筒、烧杯、 ____________________
(2)移取K2Cr2O7溶液选用的仪器是___________,盛装待测硫酸亚铁溶液选用的仪器是___________
A.50mL酸式滴定管 B.25mL碱式滴定管 C.25mL量筒
(3)氧元素位于周期表的______分区,铁元素在周期表中的位置是___________________,Fe2+的简化电子排布式为_________________,基态铬原子的价电子电子排布图为 __________________。
(4)测得FeSO4的浓度为 ______________ 。(小数点后保留两位数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)

(1)由E形成的物质中硬度最大的是___(填名称),属于___(填“晶体类型”)。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是___,该碱溶液与D的最高价氧化物反应的离子方程式___。
(3)常用作光导纤维的是___。
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序___。
(5)H、J、K的最高价氧化物对应水化物的酸性由强到弱的顺序___。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是___。
(7)元素I的氢化物的结构式为___;该氢化物常温下和元素K的单质反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:

回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍,A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是__;
(2)已知:
ⅰ.![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ.![]()
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去.

请回答:
①步骤Ⅰ的目的是__;
②若G为气体,且相对分子质量是44,则E的结构简式是__;E的核磁共振氢谱中有__个吸收峰(填数字);
③F→H的反应类型是__;
④F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式__;
⑤A的结构简式是__;
上述转化中B→D的化学方程式是__;
(3)已知A的某种同分异构体K具有如下性质:
①K与FeCl3反应,溶液呈紫色
②K在一定条件下可发生银镜反应
③K分子中苯环上的取代基上无甲基
请写出K所有可能的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素(F、Cl、Br、I)是典型的非金属元素,它们的单质及化合物在生产生活中用途广泛。请回答下列问题:
(1)氟原子的价电子排布式为___,其原子核外电子能量最高轨道的电子云形状为__。
(2)同主族元素的第一电离能大小存在一定的规律,卤族元素(F、Cl、Br、I)中,第一电离能由大到小的顺序是___。
(3)氯元素价态多样,可以与氧元素形成多种阴离子,其中ClO3的空间构型为__,ClO4中氯原子的杂化方式为____,请写出一种与ClO4互为等电子体的微粒____。
(4)HF的相对分子质量小于HCl,但沸点却高于HCl,原因是____。
(5)CaF2的晶胞结构如图所示,其中氟离子的配位数是___。已知晶胞中相邻最近的两个Ca2+的核间距为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___g·cm3。(列出计算式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态,其电路工作原理如图所示。下列说法中正确的是
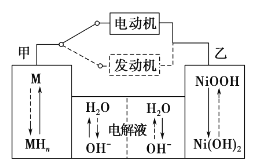
A. 放电时甲为负极,充电时为阳极
B. 电池充电时,OH—由甲侧向乙侧移动
C. 放电时负极的电极反应式为:MHn—ne—=M+nH+
D. 汽车下坡时发生图中实线所示的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com