
【题目】“502”胶水的主要成分为![]() ,下列说法错误的是( )
,下列说法错误的是( )
A. 该物质的分子式为C5H5NO2
B. 该物质难溶于水,易溶于苯等有机溶剂
C. 该物质可使酸性高锰酸钾溶液褪色
D. 该物质可经缩聚反应固化粘着
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答
(5)②和③按原子数1:2形成的化合物的电子式为____________,该晶体气化的过程中克
服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁流程如下:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:___________,指出使用空气的优点是:_________。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s)ΔH=-Q1kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=_________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=___________,c(Mg2+)=___________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时Fe(OH)3沉淀中可能混有的杂质是______ (填化学式,下同),用_______试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为Zn+2OH2e===Zn(OH)2,Ag2O+H2O+2e===2Ag+2OH。下列叙述中正确的是( )
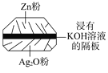
A. 在使用过程中,电解质KOH不断被消耗
B. 使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn电极发生还原反应,Ag2O电极发生氧化反应
D. Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将W1g光亮的铜丝在空气中加热一段时间后,迅速伸入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2g。实验时由于所伸入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是( )
A.NaOH溶液,W1=W2B.NaHSO4溶液,W1<W2
C.无水乙醇,W1=W2D.CO,W1>W2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )
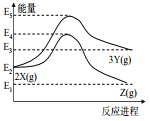
A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1氨水中存在如下电离平衡:NH3·H2O ![]() NH4++OH-,对于该平衡,下列叙述正确的是
NH4++OH-,对于该平衡,下列叙述正确的是
A. 加入水时,溶液中c(OH-) 增大
B. 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小
C. 通入少量HCl气体,溶液中c(NH4+)增大
D. 降低温度,促进NH3·H2O电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)![]() 3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。

下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com