
【题目】在0.1 mol·L-1氨水中存在如下电离平衡:NH3·H2O ![]() NH4++OH-,对于该平衡,下列叙述正确的是
NH4++OH-,对于该平衡,下列叙述正确的是
A. 加入水时,溶液中c(OH-) 增大
B. 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小
C. 通入少量HCl气体,溶液中c(NH4+)增大
D. 降低温度,促进NH3·H2O电离
科目:高中化学 来源: 题型:
【题目】如图所示分别是某课外活动小组设计的制取氨气并用氨气进行喷泉实验的三组装置,回答下列问题:
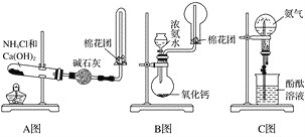
(1)用A图所示的装置可制备干燥的NH3:
①反应的化学方程式为____。装置中收集NH3的试管口放置棉花团的作用是____。
②干燥管中干燥剂能否改用无水CaCl2?____(填“能”或“不能”),理由是___(用化学方程式表示)。
(2)用B图所示的装置可快速制取较大量NH3:
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:_____。
②检验NH3是否收集满的实验方法是_____。
(3)用C图所示的装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是____,该实验的原理是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“502”胶水的主要成分为![]() ,下列说法错误的是( )
,下列说法错误的是( )
A. 该物质的分子式为C5H5NO2
B. 该物质难溶于水,易溶于苯等有机溶剂
C. 该物质可使酸性高锰酸钾溶液褪色
D. 该物质可经缩聚反应固化粘着
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池成本低、安全性好,有望在未来取代锂离子电池,某新型可充电钠离子电池放电的工作原理如图所示。下列分析错误的是( )
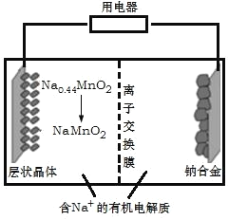
A. 出于环保考虑,应尽量避免使用重金属(如Pb)作为钠的合金化元素
B. 放电时,Na+由右室移向左室
C. 放电时,正极反应式为:Na0.44MnO2+0.56e-+0.56Na+=NaMnO2
D. 充电时,阴极质量变化4.6g时,外电路中通过0.1mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠的生产过程如图:

已知:Na2FeO4中在碱性环境中稳定存在。
请回答以下问题:
(1)Na2FeO4中铁元素的化合价为__;下列标志中应贴在盛装Na2FeO4容器上的是__。

(2)菱铁矿粉碎的目的是__,写出“碱浸”过程中SiO2所发生反应的化学方程式为__。
(3)操作1与操作2的实验名称均为____,步骤③的目的是将Fe2+氧化成Fe3-,其离子方程式为___。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理为__。
(5)已知4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH__(填“高”或“低”)。
4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH__(填“高”或“低”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生反应的总化学方程式:2Fe+2H2O+O2=2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图所示。下列说法正确的是
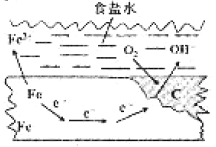
A. 铁片发生还原反应而被腐蚀
B. 铁片腐蚀生成的铁锈可以保护内层的铁不被腐蚀
C. 铁片腐蚀过程中负极发生的电极反应:2H2O+O2+4e-=4OH-
D. 铁片里的铁和碳与食盐水形成了无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为准确测定FeSO4的浓度,可用重铬酸钾标准溶液进行滴定。(已知重铬酸钾被还原为Cr3+)
步骤1.用分析天平准确称取2.9400g重铬酸钾,配制500mL重铬酸钾标准溶液;
步骤2.移取25.00mL所配制的重铬酸钾标准溶液于500mL锥形瓶中,用蒸馏水稀释至250mL,再加20mL浓硫酸,冷却后,加2~3滴试亚铁灵指示剂;
步骤3.用待测硫酸亚铁溶液滴定至溶液由橙黄到绿,由绿色刚变为红紫色为终点;
步骤4.记录消耗硫酸亚铁溶液的体积为18.70 mL。
(1)配制500mL重铬酸钾标准溶液需要的玻璃仪器有量筒、烧杯、 ____________________
(2)移取K2Cr2O7溶液选用的仪器是___________,盛装待测硫酸亚铁溶液选用的仪器是___________
A.50mL酸式滴定管 B.25mL碱式滴定管 C.25mL量筒
(3)氧元素位于周期表的______分区,铁元素在周期表中的位置是___________________,Fe2+的简化电子排布式为_________________,基态铬原子的价电子电子排布图为 __________________。
(4)测得FeSO4的浓度为 ______________ 。(小数点后保留两位数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)

(1)由E形成的物质中硬度最大的是___(填名称),属于___(填“晶体类型”)。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是___,该碱溶液与D的最高价氧化物反应的离子方程式___。
(3)常用作光导纤维的是___。
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序___。
(5)H、J、K的最高价氧化物对应水化物的酸性由强到弱的顺序___。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是___。
(7)元素I的氢化物的结构式为___;该氢化物常温下和元素K的单质反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素(F、Cl、Br、I)是典型的非金属元素,它们的单质及化合物在生产生活中用途广泛。请回答下列问题:
(1)氟原子的价电子排布式为___,其原子核外电子能量最高轨道的电子云形状为__。
(2)同主族元素的第一电离能大小存在一定的规律,卤族元素(F、Cl、Br、I)中,第一电离能由大到小的顺序是___。
(3)氯元素价态多样,可以与氧元素形成多种阴离子,其中ClO3的空间构型为__,ClO4中氯原子的杂化方式为____,请写出一种与ClO4互为等电子体的微粒____。
(4)HF的相对分子质量小于HCl,但沸点却高于HCl,原因是____。
(5)CaF2的晶胞结构如图所示,其中氟离子的配位数是___。已知晶胞中相邻最近的两个Ca2+的核间距为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___g·cm3。(列出计算式)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com