
����Ŀ����������(Na2FeO4)���к�ǿ�������ԣ���һ�����͵���ɫ��ˮ����������ҵ����������(��Ҫ�ɷ���FeCO3������SiO2)Ϊԭ���Ʊ��������Ƶ�����������ͼ��

��֪��Na2FeO4���ڼ��Ի������ȶ����ڡ�
��ش��������⣺
��1��Na2FeO4����Ԫ�صĻ��ϼ�Ϊ__�����б�־��Ӧ����ʢװNa2FeO4�����ϵ���__��

��2������������Ŀ����__��д���������������SiO2��������Ӧ�Ļ�ѧ����ʽΪ__��
��3������1�����2��ʵ�����ƾ�Ϊ____������۵�Ŀ���ǽ�Fe2��������Fe3���������ӷ���ʽΪ___��
��4����������������Ļ�ԭ������о�ˮ���ã����;�ˮԭ��Ϊ__��
��5����֪4FeO42����10H2O![]() 4Fe(OH)3��8OH����3O2������һ������Na2FeO4Ͷ�뵽pH��ͬ�Ĺ�ҵ��ˮ��(��ˮ������ɷ־���ͬ)�������Һ��Na2FeO4Ũ�ȱ仯��ͼ���ߢ���ʾ���Է������ߢ�����ߢ��Ӧ����ˮpH__(����������������)��
4Fe(OH)3��8OH����3O2������һ������Na2FeO4Ͷ�뵽pH��ͬ�Ĺ�ҵ��ˮ��(��ˮ������ɷ־���ͬ)�������Һ��Na2FeO4Ũ�ȱ仯��ͼ���ߢ���ʾ���Է������ߢ�����ߢ��Ӧ����ˮpH__(����������������)��

���𰸡�+6�ۣ� d�� ����Ӧ�ĽӴ�������ӿ컯ѧ��Ӧ���ʣ� SiO2+2NaOH=NaSiO3+H2O�� ���ˣ� 2Fe2++ ClO-+2H+=2Fe3++Cl- + H2O�� ���ɵ����������ӿ��Է���ˮ�����������������壬����������������������ã���������ˮ���� �ߣ�
��������
������������Ҫ�ɷ���FeCO3������SiO2��������NaOH��Һ���ܣ�SiO2��NaOH��Ӧ�õ���������Һ�����ˣ�������Ҫ����FeCO3������ϡ�����ܽ⣬�õ�Fe2+��������Һ������NaClO��Һ����Fe2+��2Fe2++ClO-+2H+=2Fe3++Cl-+H2O���ټ���NaOH��NaClO��Һ��������Fe3+����ӦΪ��2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O����õ���Na2FeO4��Һ�м��������������ƹ���õ�����Һ�����˵õ��������ơ�
��1��Na2FeO4����Ԫ�صĻ��ϼ�Ϊ+6�ۣ�����������м�ǿ�������ԣ�����Ӧ�����������ı�ǩ��
��2������������Ŀ��������Ӧ�ĽӴ�������ӿ컯ѧ��Ӧ���ʣ�д���������������SiO2���������Ʒ�Ӧ����Ӧ�Ļ�ѧ��Ӧ����ʽΪ��SiO2+2NaOH=NaSiO3+H2O��
��3������1�����2��ʵ�����ƾ�Ϊ���ˣ��������Fe2���ʹ������Ʒ�Ӧ����Fe3�������ӷ���ʽΪ��2Fe2++ ClO-+2H+=2Fe3++Cl- + H2O��
��4����������������Ļ�ԭ���������������ӣ����������ӿ��Է���ˮ�ⷴӦ��Fe3++3H2O![]() Fe��OH��3�����壩+3H+�����ɾ��������Ե������������壬����Ҳ���Ծ�ˮ��
Fe��OH��3�����壩+3H+�����ɾ��������Ե������������壬����Ҳ���Ծ�ˮ��
��5�����ݷ�Ӧ����ʽ�в������������жϵ���ҺΪ����ʱ�����Ƹ������ˮ�⣬ʹƽ���������ƶ������������Ũ�Ƚϴ����Խ��ͼ������PH������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ���ʺ��ȵ�˵���У���ȷ���ǣ� ��
A.�������ᷴӦʱ����������һ��ʱ������ԽŨ����Ӧ����Խ��
B.�ڽ�����������ˮ��Ӧ�У�����ˮ�����ܼӿ췴Ӧ����
C.��2SO2+O2![]() 2SO3��Ӧ�м���18O2���ﵽƽ���SO2�в����ܺ���18O2
2SO3��Ӧ�м���18O2���ﵽƽ���SO2�в����ܺ���18O2
D.���������Ȼ��Ƿ��ȷ�Ӧ�����ȶ��ܼӿ컯ѧ��Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ŧ�۵�����ִ��������й㷺Ӧ�á���һ����п��أ���缫���Ϸֱ���Ag2O��Zn���������ҺΪKOH��Һ���缫��ӦʽΪZn+2OH2e===Zn(OH)2��Ag2O+H2O+2e===2Ag+2OH��������������ȷ���ǣ� ��
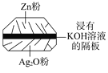
A. ��ʹ�ù����У������KOH���ϱ�����
B. ʹ�ù����У�������Ag2O�������·����Zn��
C. Zn�缫������ԭ��Ӧ��Ag2O�缫����������Ӧ
D. Zn�Ǹ�����Ag2O������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɷ�Ӧ�� X �ֱ�ת��Ϊ Y �� Z �������仯��ͼ��ʾ������˵����ȷ����( )
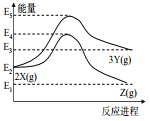
A���� X��Z ��Ӧ�� ��H<0 B���� X��Y ��Ӧ�� ��H=E5-E2
C������ѹǿ��������� Y �IJ��� D�������¶���������� Z �IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ͻ𱻳�Ϊ����Ͻ���һ�־��ж�����״���书�ܡ���ĥ�𡢿���ʴ�������Ե��ص�Ĺ��ܲ��ϣ������ں��պ��졢ҽ�Ƶ����ش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ __________�����������ڵ�һ��������С��Ԫ������Ϊ__��
��2�������� H2SO4��HNO3�ȶ������ʴ�����������������ѵ��м���
���������Ѿ�����������Ϊ��ͼ1��ʾ��״�ۺ���ʽ�����ӣ��þ���Ļ�ѧʽΪ_�������д��ڵ����������������Ӽ���___��____��

�ڲ�����֪H2SO4��HNO3�ķе�ֱ�Ϊ338���83�棬�Է�����������Ҫԭ��__��
��3����������������Ԫ�أ��������ж��������շ���֢���������ж�ͨ���ö��һ�����������ƣ��ṹ��ͼ2���ⶾ����������̼ԭ�ӵ��ӻ���ʽ��___��

��4��Ni��O��Cr �����γ�һ�־���������Եĸ��������ᄃ���ṹ��ͼ3������������Ϊapm��������Cr4+λ��O2-���γɵ�������������ģ�����������ı߳�Ϊ__pm���谢���ӵ�������ֵΪNA����þ����ܶ�Ϊ__g��cm-3��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol��L��1��ˮ�д������µ���ƽ�⣺NH3��H2O ![]() NH4����OH�������ڸ�ƽ�⣬����������ȷ����
NH4����OH�������ڸ�ƽ�⣬����������ȷ����
A. ����ˮʱ����Һ��c(OH��) ����
B. ��������NH4Cl���壬ƽ�����淽���ƶ�������ƽ�ⳣ����С
C. ͨ������HCl���壬��Һ��c(NH4��)����
D. �����¶ȣ��ٽ�NH3��H2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
I.�������ʵ�����A��B��Ϸ���2 L���ܱ������У�������Ӧ3A(g)��B(g)![]() xC(g)��2D(g)����5 min��ﵽƽ�⣬ƽ��ʱ���D��Ũ��Ϊ0.5mol/L��c(A)��c(B)=3��5��v(C)=0��1 mol/(L��min)����
xC(g)��2D(g)����5 min��ﵽƽ�⣬ƽ��ʱ���D��Ũ��Ϊ0.5mol/L��c(A)��c(B)=3��5��v(C)=0��1 mol/(L��min)����
(1)x=________��
(2)ǰ5 min��B�ķ�Ӧ����v(B)=_________��
(3)ƽ��ʱA��ת����Ϊ_________��
II.ˮ����ͨ�����ȵ�̼�㷢����Ӧ��C(s)+H2O(g)![]() CO(g)+H2(g)��H��
CO(g)+H2(g)��H��
(4)��֪��K(300��)��K(350��)����÷�Ӧ��_________�ȷ�Ӧ��
(5)������Ӧ��t0ʱ�̴ﵽƽ�⣬��t1ʱ�̸ı�ijһ����������Ӧ����(v��)��ʱ��ı仯����ͼ��ʾ�������Ӧ�ı�š�

�� ���������_________��
�� �����¶� ____________��
(6)��֪��Ӧ��CO(g)+CuO(g)![]() CO2(g)+Cu(s)����H2(g)+CuO(g)
CO2(g)+Cu(s)����H2(g)+CuO(g)![]() Cu(s)+H2O(g)������ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�ӦCO(g)+H2O(g)
Cu(s)+H2O(g)������ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�ӦCO(g)+H2O(g)![]() CO2(g)+H2(g)��ƽ�ⳣ��K=__________(��K1��K2��ʾ)��
CO2(g)+H2(g)��ƽ�ⳣ��K=__________(��K1��K2��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20����5.05��105Pa�����£��ܱ������н��з�Ӧ2A(g)+xB(g)![]() 4C(g)����ƽ��ʱc(A)=1.00molL-1���ֽ�ѹǿ��С��1.01��105Pa������ƽ���c(A)=0.18molL-1��������˵����ȷ���� ( )
4C(g)����ƽ��ʱc(A)=1.00molL-1���ֽ�ѹǿ��С��1.01��105Pa������ƽ���c(A)=0.18molL-1��������˵����ȷ���� ( )
A��ϵ��x >2
B�����������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ����С
C�����������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ,����������ȷ����
A��1.0 L 1.0 molL��1 ��NaAlO2ˮ��Һ�к��е���ԭ����Ϊ2 NA
B�������£�0.l mol̼���ƾ����к���CO32�� �ĸ���Ϊ0.1![]()
C����״���£�11.2L 18O2������������Ϊ8NA
D��25��ʱ��l L pH=13��Ba(OH)2��Һ�к��е�OH�� ��Ϊ0.2![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com