
【题目】钛镍合金被称为记忆合金,是一种具有独特形状记忆功能、耐磨损、抗腐蚀、超弹性等特点的功能材料,主用于航空航天、医疗等领域。回答下列问题:
(1)基态镍原子的价电子排布式为 __________,其所在周期第一电离能最小的元素名称为__。
(2)钛铁矿经过 H2SO4、HNO3等多种物质处理后会生成硫酸氧钛等中间产物。
①硫酸氧钛晶体中阳离子为如图1所示链状聚合形式的离子,该晶体的化学式为_,晶体中存在的微粒间作用力有离子键、___和____。

②查资料知H2SO4和HNO3的沸点分别为338℃和83℃,试分析差异大的主要原因__。
(3)镍是人体必需的微量元素,但超量中毒易过敏或诱发癌症。急性镍中毒通常用二乙基二硫代氨基钠(结构如图2)解毒,该物质中碳原子的杂化方式有___。

(4)Ni、O、Cr 可以形成一种具有特殊导电性的复合氧化物晶胞结构如图3。若晶胞参数为apm,晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为__pm。设阿伏加德罗常数数值为NA,则该晶体密度为__g·cm-3。

【答案】![]() 钾 TiOSO4 共价键 配位键 H2SO4只能形成分子间氢键,HNO3能形成分子内氢键 sp2、sp3
钾 TiOSO4 共价键 配位键 H2SO4只能形成分子间氢键,HNO3能形成分子内氢键 sp2、sp3 ![]() a
a 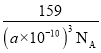
【解析】
(1)镍为28号元素,基态镍原子的价电子排布式为![]() ,同周期元素第一电离能有依次增大的趋势。镍为第四周期,所在周期第一电离能最小的元素名称为钾。
,同周期元素第一电离能有依次增大的趋势。镍为第四周期,所在周期第一电离能最小的元素名称为钾。
(2)①如图在阳离子中每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法可知,每个钛原子实际占有的氧原子为2×![]() =1,所以二者原子个数之比为1:1。所以晶体的化学式为TiOSO4,S和OTi中的O形成一般的共价键,然后S还有4个电子,分别和两个O形成配位键,分子中存在离子键、共价键和配位键。
=1,所以二者原子个数之比为1:1。所以晶体的化学式为TiOSO4,S和OTi中的O形成一般的共价键,然后S还有4个电子,分别和两个O形成配位键,分子中存在离子键、共价键和配位键。
②H2SO4和HNO3除了含有共价键之外,都能够形成氢键,H2SO4只能形成分子间氢键,HNO3能形成分子内氢键。
(3)根据结构图2,分子中有碳双键,该碳为sp2杂化,分子中有甲基,碳原子为sp3杂化。
(4)正八面体的两个顶点与体心原子形成等腰直角三角形,正八面体的边长等于该等腰直角三角形的直角边长度的![]() 倍,而等腰直角三角形的直角边长度等于晶胞棱长的一半,故该正八面体的边长为:
倍,而等腰直角三角形的直角边长度等于晶胞棱长的一半,故该正八面体的边长为:![]() a pm;晶胞质量=
a pm;晶胞质量=![]() g,晶体密度=
g,晶体密度=![]() g÷(a×10-10cm)3
g÷(a×10-10cm)3
即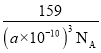


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )

A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸是重要的有机合成原料及合成树脂单体,可通过以下方式制得:CH![]() CH
CH![]() CH2=CHCOOH,下列有关说法错误的是( )
CH2=CHCOOH,下列有关说法错误的是( )
A. CO分子的碳氧叁键中存在配位键
B. 丙烯酸分子中σ键与π键的个数比为4∶1
C. 乙炔和水均为极性分子
D. 丙烯酸具有酸性,且能发生加成反应、聚合反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
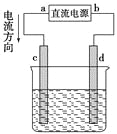
A. a为负极,b为正极
B. a为阳极,b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠的生产过程如图:

已知:Na2FeO4中在碱性环境中稳定存在。
请回答以下问题:
(1)Na2FeO4中铁元素的化合价为__;下列标志中应贴在盛装Na2FeO4容器上的是__。

(2)菱铁矿粉碎的目的是__,写出“碱浸”过程中SiO2所发生反应的化学方程式为__。
(3)操作1与操作2的实验名称均为____,步骤③的目的是将Fe2+氧化成Fe3-,其离子方程式为___。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理为__。
(5)已知4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH__(填“高”或“低”)。
4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH__(填“高”或“低”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅、铜、镓、硒等化学物质可作为制造太阳能电池板的材料。
(1)镓是ⅢA族元素,写出基态镓原子的核外电子排布式__________________。
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由大到小的顺序为______________(用元素符号表示)。
(3)SeO3分子的立体构型为____,与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为____。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化的原因是____________。

(5)金属铜投入氨水中或投入过氧化氢溶液中均无明显现象,但投入氨水与过氧化氢的混合液中,则铜片溶解,溶液呈深蓝色,写出使溶液呈深蓝色的离子的化学式_____。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数之比为____________,若该晶体的晶胞边长为a pm,则该合金的密度为________________g·cm-3(列出计算式,不要求计算结果,设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定溶液中一定能大量共存的离子组是
A. 含有大量AlO![]() 的溶液中:Na+、K+、HCO3-、NO3-
的溶液中:Na+、K+、HCO3-、NO3-
B. pH=1的溶液中:NH4+、Na+、Fe3+、SO42-
C. 水电离产生c(H+)=1×10-13 mol/L溶液中:K+、Al3+、Cl-、SO42-
D. Na2S溶液中:SO42-、K+、Cu2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POC13常用作半导体掺杂剂及光导纤维原料,实验室制备POC13并测定产品含量的实验过程如下:
I.实验室制备POC13。采用氧气氧化液态PCl3法制取POC13,实验装置(加热及夹持仪器略)如下图:
资料:①Ag++SCN-=AgSCN↓ Ksp(AgCl)>Ksp(AgSCN);

②PCl3和POC13的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POC13 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称____________________。
(2)B中所盛的试剂是________,干燥管的作用是_____________________。
(3)POC13遇水反应的化学方程式为____________________________。
(4)反应温度要控制在60~65℃,原因是:____________________________。
II.测定POC13产品的含量。实验步骤:
①制备POC13实验结束后,待三颈瓶中的液体冷却至室温,准确称取29.1g产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
②取10.00 mL溶液于锥形瓶中,加入20.00 mL 3.5mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用1.00mol/LKSCN溶液滴定过量AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
(5)步骤④中X可以选择___________________ 。
(6)步骤③若不加入硝基苯,会导致测量结果______(填偏高,偏低,或无影响)
(7)反应产物中POC13的质量百分含量为___________________, 若滴定终点,读取KSCN溶液俯视刻度线,则上述结果____________(填偏高,偏低,或无影响)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com