
【题目】下列指定溶液中一定能大量共存的离子组是
A. 含有大量AlO![]() 的溶液中:Na+、K+、HCO3-、NO3-
的溶液中:Na+、K+、HCO3-、NO3-
B. pH=1的溶液中:NH4+、Na+、Fe3+、SO42-
C. 水电离产生c(H+)=1×10-13 mol/L溶液中:K+、Al3+、Cl-、SO42-
D. Na2S溶液中:SO42-、K+、Cu2+、Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。
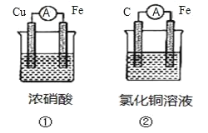
(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。

实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛镍合金被称为记忆合金,是一种具有独特形状记忆功能、耐磨损、抗腐蚀、超弹性等特点的功能材料,主用于航空航天、医疗等领域。回答下列问题:
(1)基态镍原子的价电子排布式为 __________,其所在周期第一电离能最小的元素名称为__。
(2)钛铁矿经过 H2SO4、HNO3等多种物质处理后会生成硫酸氧钛等中间产物。
①硫酸氧钛晶体中阳离子为如图1所示链状聚合形式的离子,该晶体的化学式为_,晶体中存在的微粒间作用力有离子键、___和____。

②查资料知H2SO4和HNO3的沸点分别为338℃和83℃,试分析差异大的主要原因__。
(3)镍是人体必需的微量元素,但超量中毒易过敏或诱发癌症。急性镍中毒通常用二乙基二硫代氨基钠(结构如图2)解毒,该物质中碳原子的杂化方式有___。

(4)Ni、O、Cr 可以形成一种具有特殊导电性的复合氧化物晶胞结构如图3。若晶胞参数为apm,晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为__pm。设阿伏加德罗常数数值为NA,则该晶体密度为__g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
I.将等物质的量的A、B混合放于2 L的密闭容器中,发生反应3A(g)+B(g)![]() xC(g)+2D(g)。经5 min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A)∶c(B)=3:5,v(C)=0.1 mol/(L·min)。则:
xC(g)+2D(g)。经5 min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A)∶c(B)=3:5,v(C)=0.1 mol/(L·min)。则:
(1)x=________。
(2)前5 min内B的反应速率v(B)=_________。
(3)平衡时A的转化率为_________。
II.水蒸气通过炙热的碳层发生反应:C(s)+H2O(g)![]() CO(g)+H2(g)△H。
CO(g)+H2(g)△H。
(4)已知:K(300℃)<K(350℃),则该反应是_________热反应。
(5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(v正)随时间的变化如下图所示,填出对应的编号。

① 缩小容器体积_________;
② 降低温度 ____________;
(6)已知反应①CO(g)+CuO(g)![]() CO2(g)+Cu(s),②H2(g)+CuO(g)
CO2(g)+Cu(s),②H2(g)+CuO(g)![]() Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应CO(g)+H2O(g)
Cu(s)+H2O(g),在相同的某温度下的平衡常数分别为K1和K2,该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K=__________(用K1和K2表示)。
CO2(g)+H2(g)的平衡常数K=__________(用K1和K2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质
①O2和O3 ②H2、D2、T2 ③12C和14C ④CH3CH2CH2CH3和(CH3)2CHCH3 ⑤乙烷和丁烷 ⑥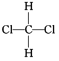 和
和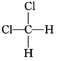 ⑦
⑦![]() 和
和![]() ⑧氯气和氯水 ⑨红磷和白磷
⑧氯气和氯水 ⑨红磷和白磷
互为同位素的是___(填序号,下同),互为同素异形体的是___,互为同系物的是__,互为同分异构体的是__,属于同一物质的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)![]() 4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
4C(g),达平衡时c(A)=1.00molL-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18molL-1,则下列说法正确的是 ( )
A.系数x >2
B.若增大该体系的压强,平衡向左移动,化学平衡常数变小
C.若增大该体系的压强,平衡向右移动,化学平衡常数不变
D.该反应的化学平衡常数表达式是K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石)ΔH=+1.9kJ·mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)ΔH=-285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。

装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充放电的化学方程式为2Na2S2+NaBr3化气![]() Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr。当闭合开关K时,X电极附近溶液变红。下列说法正确的是
A. 闭合开关K时,钠离子从右到左通过离子交换膜
B. 闭合开关K时,负极反应式为:3NaBr-2e-=NaBr3+2Na+
C. 闭合开关K时,X电极反应式为:2Cl--2e-=Cl2↑
D. 闭合开关K时,当有0.1molNa+通过离子交换膜,X电极上析出标准状况下气体1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为________;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2↑+_____H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是_________,
②乙二酸分解的化学方程式为 ________;
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:_______(用离子符号表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com