
【题目】下列有关化学反应速率和限度的说法中,正确的是( )
A.铁与硝酸反应时,其他条件一定时,硝酸越浓,反应速率越快
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.在2SO2+O2![]() 2SO3反应中加入18O2,达到平衡后SO2中不可能含有18O2
2SO3反应中加入18O2,达到平衡后SO2中不可能含有18O2
D.无论是吸热还是放热反应,加热都能加快化学反应速率
科目:高中化学 来源: 题型:
【题目】合成氨是人类科技发展史上的一项重大突破。已知25℃时,合成氨反应的热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ/mol。请回答下列问题:
2NH3(g) △H=-92.4 kJ/mol。请回答下列问题:
(1)保持容器温度不变,缩小容器体积,化学反应速率_______(填“增大”或“减小”)。
(2)25℃时,取一定量的N2和H2于2 L的密闭容器中在催化剂存在下进行反应达到平衡,若增大N2的浓度,则H2的转化率____(填“增大”或“减小”);若反应达到平衡时放出的热量是92.4 kJ,则生成的NH3为______________mol。
(3)恒温恒容条件下,上述反应达到化学平衡状态的标志是________(填字母代号)。
A. N2、H2、NH3的浓度相等
B.容器内压强不再变化
C.单位时间内消耗a mol N2,同时生成2a mol NH3
(4)上述反应平衡常数的表达式为K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:

回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是

实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | 亚硫酸钠 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | 高锰酸钾 | 淀粉碘化钾溶液 | 溶液会变蓝 |
C | 稀盐酸 | 碳酸钙 | 氯化钡溶液 | 有白色沉淀生成 |
D | 浓氨水 | 氧化钙 | 氯化铝溶液 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )

A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示分别是某课外活动小组设计的制取氨气并用氨气进行喷泉实验的三组装置,回答下列问题:
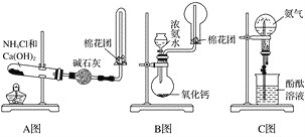
(1)用A图所示的装置可制备干燥的NH3:
①反应的化学方程式为____。装置中收集NH3的试管口放置棉花团的作用是____。
②干燥管中干燥剂能否改用无水CaCl2?____(填“能”或“不能”),理由是___(用化学方程式表示)。
(2)用B图所示的装置可快速制取较大量NH3:
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:_____。
②检验NH3是否收集满的实验方法是_____。
(3)用C图所示的装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是____,该实验的原理是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是难溶氢氧化物在不同pH下的溶解度(S),下列说法正确的是( )
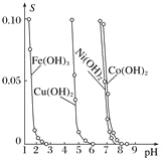
A. pH=3时溶液中铁元素的主要存在形式是Fe3+
B. 若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法除去
C. 若要分离溶液中的Fe3+和Cu2+,可调节溶液的pH为4
D. 若向含有相同物质的量浓度的Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
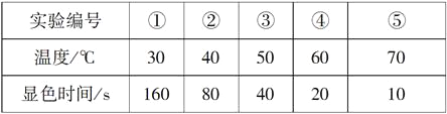
回答下列问题:
(1)该反应的离子方程式为_____________________________________。
(2)该实验的目的是__________________________________。
(3)实验试剂除了1 mol·L-1KI溶液、0.1 mol·L-1H2SO4溶液外,还需要的试剂是________,实验现象为_____________________________。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________(填字母)。
A.温度
B.试剂的浓度
C.试剂的用量(体积)
D.试剂添加的顺序
(5)由上述实验记录可得出的结论是_________________________。
(6)若要进行溶液酸性大小对反应速率的影响的探究实验,你会采取的措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠的生产过程如图:

已知:Na2FeO4中在碱性环境中稳定存在。
请回答以下问题:
(1)Na2FeO4中铁元素的化合价为__;下列标志中应贴在盛装Na2FeO4容器上的是__。

(2)菱铁矿粉碎的目的是__,写出“碱浸”过程中SiO2所发生反应的化学方程式为__。
(3)操作1与操作2的实验名称均为____,步骤③的目的是将Fe2+氧化成Fe3-,其离子方程式为___。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理为__。
(5)已知4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH__(填“高”或“低”)。
4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH__(填“高”或“低”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com