
【题目】(1)同分异构现象在有机化合物中是非常普遍的。下列各组化合物:
①CH3CH2CH2CH3和(CH3)2CHCH3;②CH3CH2OH和CH3CH2CH2OH;③CH3CH=CHCH3和CH3CH2CH=CH2;④![]() 和
和![]() ,其中互为同分异构体的是_______(填序号)。
,其中互为同分异构体的是_______(填序号)。
(2)下列属于酚的是________。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]()
(3)如图所示是几种烷烃的球棍模型,试回答下列问题:
A、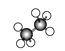 B、
B、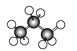 C、
C、![]()
①A、B、C三者的关系是____。
②A的分子式为____,C的名称为_____。
③写出C的同分异构体的结构简式:_________。
【答案】①③ ④⑤ 同系物 C2H6 丁烷 ![]()
【解析】
(1)分子式相同,结构不同的有机物互为同分异构体,根据定义进行判断;
(2)羟基直接连接在苯环上得到的有机物为酚,据此分析;
(3)由球棍模型可知A为乙烷,B为丙烷,C为丁烷,三者互为同系物,就此分析。
(1)①CH3CH2CH2CH3和(CH3)2CHCH3分子式相同,结构不同,互为同分异构体,正确;
②CH3CH2OH和CH3CH2CH2OH结构相似,分子组成相差一个CH2原子团,属于同系物,错误;
③CH3CH=CHCH3和CH3CH2CH=CH2分子式相同,结构不同,互为同分异构体,正确;
④![]() 和
和![]() ,分子式不同,不属于同分异构体,错误;
,分子式不同,不属于同分异构体,错误;
互为同分异构体的是①③
(2)①![]() 属于醇;②
属于醇;②![]() 结构中羟基没有直接和苯环相连,属于醇;③
结构中羟基没有直接和苯环相连,属于醇;③![]() 结构中不含有苯环,不是酚,属于醇;④
结构中不含有苯环,不是酚,属于醇;④![]() 结构中羟基直接和苯环相连,属于酚;⑤
结构中羟基直接和苯环相连,属于酚;⑤![]() 结构中羟基直接和苯环相连,属于酚;⑥
结构中羟基直接和苯环相连,属于酚;⑥![]() 结构中羟基没有直接和苯环相连,属于醇;因此属于酚的是④⑤;
结构中羟基没有直接和苯环相连,属于醇;因此属于酚的是④⑤;
(3)由分析可知,A为乙烷,B为丙烷,C为丁烷;
①A、B、C三者的关系是同系物;
②A为乙烷,分子式为C2H6,C的名称为丁烷;
③C为丁烷,同分异构体有正丁烷和异丁烷两种,分别为CH3CH2CH2CH3和![]()


科目:高中化学 来源: 题型:
【题目】室温下,水的电离达到平衡:H2O![]() H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
A. 将水加热,平衡向正反应方向移动,Kw不变
B. 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C. 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D. 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2
B.苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构
C.甲苯(![]() )可以发生取代反应,不能发生加成反应
)可以发生取代反应,不能发生加成反应
D.正己烷的沸点高于2-甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列结构简式命名或根据名称写出结构简式:
(1)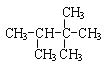 _______________________
_______________________
(2)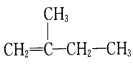 ____________________________
____________________________
(3)3—甲基—1—戊烯______________________________
(4)3,3,4-三甲基己烷______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将117 g NaCl溶于水配制成1 L溶液。
(1)该溶液中NaCl的物质的量浓度为________,溶液中Cl-的物质的量浓度为________。
(2)配制1 mol·L-1的NaCl溶液500 mL,需该溶液的体积为________。
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为________,通入HCl气体的体积(标准状况下)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)是一种常用于粮食仓储的广谱性熏蒸杀虫剂,遇水立即产生高毒性气体 PH3(沸点-89.7℃,还原性强)。国家卫计委规定粮食中磷化物(以PH3计)的残留量不超过0.0500 mg/kg时为质量合格,反之不合格。某化学兴趣小组的同学用下述方法测定某粮食样品 中残留磷化物的质量以判断是否合格。
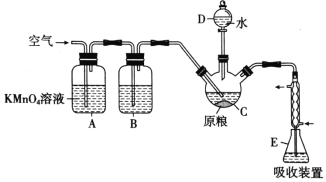
在C中加入100g原粮,E中加入20.00 mL 2.50×10-4 mol/ L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)PH3的电子式为___________。仪器C的名称是___________。
(2)A中酸性高锰酸钾溶液的作用是___________通入空气的作用是______________________。
(3)PH3也可被NaClO氧化可用于制备NaH2PO2,制得的NaH2PO2和NiCl2溶液可用于化学镀镍, 同时生成磷酸和氯化物,请写出化学镀镍的化学方程式为______________________________。
(4)装置E中PH3被氧化成磷酸,充分反应后的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-5mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液 20.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平),则滴定终点的现象为______________________________________________。
该原粮样品中磷化物(以PH3计)的残留量为__________________mg/kg。(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:KClO3+HCl(浓)== KCl+ClO2↑+Cl2↑+。
(1)请 写出完整的化学方程式并配平_______。
(2)浓盐酸在反应中显示出来的性质是_______(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)用双线桥法标明电子转移的方向和数目____。
(4)产生0.1molCl2,则转移的电子的物质的量为___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com