
【题目】磷化铝(AlP)是一种常用于粮食仓储的广谱性熏蒸杀虫剂,遇水立即产生高毒性气体 PH3(沸点-89.7℃,还原性强)。国家卫计委规定粮食中磷化物(以PH3计)的残留量不超过0.0500 mg/kg时为质量合格,反之不合格。某化学兴趣小组的同学用下述方法测定某粮食样品 中残留磷化物的质量以判断是否合格。
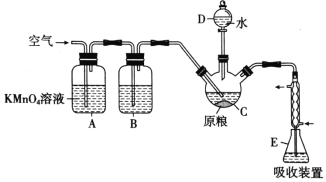
在C中加入100g原粮,E中加入20.00 mL 2.50×10-4 mol/ L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)PH3的电子式为___________。仪器C的名称是___________。
(2)A中酸性高锰酸钾溶液的作用是___________通入空气的作用是______________________。
(3)PH3也可被NaClO氧化可用于制备NaH2PO2,制得的NaH2PO2和NiCl2溶液可用于化学镀镍, 同时生成磷酸和氯化物,请写出化学镀镍的化学方程式为______________________________。
(4)装置E中PH3被氧化成磷酸,充分反应后的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-5mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液 20.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平),则滴定终点的现象为______________________________________________。
该原粮样品中磷化物(以PH3计)的残留量为__________________mg/kg。(保留三位有效数字)。
【答案】![]() 三颈烧瓶 吸收空气中的还原性气体,以免使测定结果偏高。 排出装置中空气;保证生成的PH3全部被装置E中的酸性KMnO4溶液吸收 2NiCl2+NaH2PO2+2H2O=2Ni+H3PO4+NaCl+3HCl 滴最后一滴标准液时,溶液由浅紫色变为无色,且30秒不变色 0.383
三颈烧瓶 吸收空气中的还原性气体,以免使测定结果偏高。 排出装置中空气;保证生成的PH3全部被装置E中的酸性KMnO4溶液吸收 2NiCl2+NaH2PO2+2H2O=2Ni+H3PO4+NaCl+3HCl 滴最后一滴标准液时,溶液由浅紫色变为无色,且30秒不变色 0.383
【解析】
(1)根据P、H原子结构,分析书写出PH3的电子式;结合示意图辨析仪器;
(2)根据酸性高锰酸钾溶液具有强氧化性分析;根据PH3是气体,滞留在装置中会影响粮食中残留磷化物含量的测定分析;
(3)根据电子得失守恒分析解答;
(4)根据KMnO4溶液的颜色判断,根据氧化还原反应中电子守恒计算。
(1)由于P、H两元素通过共价键结合形成化合物,H原子核外只有一个电子,只能形成一对共用电子对;P原子最外层有5个电子,可结合3个H原子形成三对共用电子对,达到8电子的稳定结构,PH3的电子式是![]() ;由示意图可知仪器C的名称是三颈烧瓶;
;由示意图可知仪器C的名称是三颈烧瓶;
(2)由于空气中也含有还原性气体会干扰后续的实验,因此A中酸性高锰酸钾溶液的作用是吸收空气中的还原性气体,以免使测定结果偏高;AlP与水发生反应产生Al(OH)3和PH3,PH3是气体,会有一部分滞留在三颈烧瓶上部空间内,若通入空气,就可以将三颈烧瓶中空气内的PH3全部赶到E内,被装置E中的酸性KMnO4溶液吸收,以减小实验误差;
(3)NaH2PO2和NiCl2溶液可用于化学镀镍,同时生成磷酸和氯化物,反应中Ni元素化合价从+2价降低到0价,P元素化合价从+1价升高到+5价,所以根据电子得失守恒可知化学镀镍的化学方程式为2NiCl2+NaH2PO2+2H2O=2Ni+H3PO4+NaCl+3HCl。
(4)由于酸性高锰酸钾溶液显紫色,则滴定终点的现象为滴入最后一滴标准液时,溶液由浅紫色变为无色,且30秒不变色;根据题意可知KMnO4得到电子的物质的量与PH3、Na2SO3失去的电子的物质的量相等,2n(Na2SO3)+8n(PH3)=5n(KMnO4),带入数值:2×10×4.0×10-5mol/L×0.02L+8 n(PH3)=5×2.50×10-4mol/L×0.02L,解得n(PH3)=1.125×10-6mol,m(PH3)=1.125×10-6mol×34g/mol=3.825×10-5g=0.03825mg;则该原粮样品中磷化物(以PH3计)的残留量为0.03825mg÷0.1kg=0.383mg/kg。


科目:高中化学 来源: 题型:
【题目】(1)同分异构现象在有机化合物中是非常普遍的。下列各组化合物:
①CH3CH2CH2CH3和(CH3)2CHCH3;②CH3CH2OH和CH3CH2CH2OH;③CH3CH=CHCH3和CH3CH2CH=CH2;④![]() 和
和![]() ,其中互为同分异构体的是_______(填序号)。
,其中互为同分异构体的是_______(填序号)。
(2)下列属于酚的是________。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]()
(3)如图所示是几种烷烃的球棍模型,试回答下列问题:
A、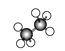 B、
B、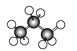 C、
C、![]()
①A、B、C三者的关系是____。
②A的分子式为____,C的名称为_____。
③写出C的同分异构体的结构简式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
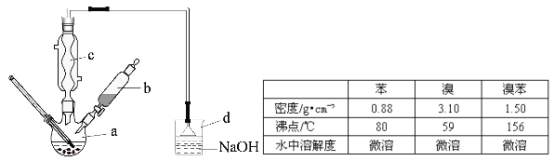
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]有机化合物F是一种重要的有机合成中间体,其合成路线如下图所示:

已知:①A的核磁共振氢谱图中显示两组峰②F的结构简式为:

③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
④![]()
请回答下列问题:
(1)A的名称为______________(系统命名法);Z中所含官能团的名称是___________。
(2)反应Ⅰ的反应条件是__________;反应Ⅲ的反应类型为__________ 。
(3)E的结构简式为_______________________。
(4)写出反应Ⅴ的化学方程式____________________________________________。
(5)写出反应IV中的化学方程式____________________________________________。
(6)W是Z的同系物,相对分子质量比Z大14,则W的同分异构体中满足下列条件:
①能发生银镜反应,②苯环上有两个取代基,③不能水解,遇FeCl3溶液不显色的结构共有_________种(不包括立体异构),核磁共振氢谱有四组峰的结构为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
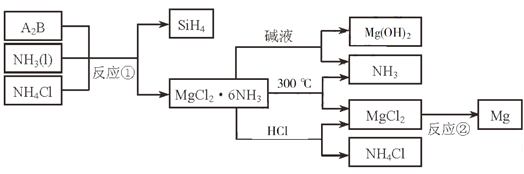
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
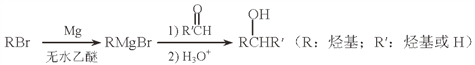
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
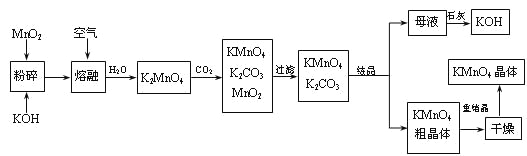
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是不溶物氢氧化铝。其治疗原理是(用离子方程式表示)_______。
(2)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是_______。
(3)反应2H2CrO4+3H2O2=2Cr(OH)3 +3O2↑+2H2O中H2O2的变化过程为H2O2→O2。
①该反应的还原剂是________(填化学式)。
②在该反应方程式中用双线桥法标明电子转移的方向和数目。________
2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
③若反应中转移了3mol电子,则产生的气体在标准状况下体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①标准状况下,1g氢气和14g氮气的体积相同
②常温常压下,16g氧气和臭氧的混合气体中含有的质子数为8NA
③0.1L 0.5mol/LCH3CH2OH溶液中含有氢原子数为0.3NA
④常温常压下,28gCO的体积大于22.4L
⑤分子总数相等的NO2和CO2,所含氧原子数均为2NA
上述表述中正确的有:_______
(2)用容量瓶配制溶液时,由于操作不当会引起误差
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
上述情况会使所配溶液浓度偏低的是 :_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com