
【题目】在恒容容器中进行如下反应:N2+3H2![]() 2NH3 △H<0,温度一定时,若将平衡体系中各物质的浓度都增加到原来的2倍,不会产生的结果是( )
2NH3 △H<0,温度一定时,若将平衡体系中各物质的浓度都增加到原来的2倍,不会产生的结果是( )
A. 平衡向正反应方向移动B. 平衡向逆反应方向移动
C. NH3的百分含量增加D. 正、逆反应速率都增大
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】化学反应中绚丽的颜色变化往往展现了化学的神奇,体现了化学之美。下列变化中的a、b、c、d可以是混合物,关于物质类别或者反应类型的叙述一定正确的是
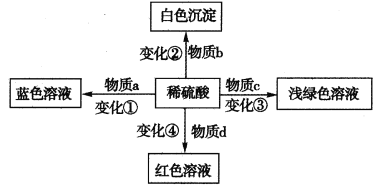
A.变化①一定不属于氧化还原反应
B.变化②得到的白色沉淀一定是硫酸盐
C.物质c中一定不能含有铁红或磁性氧化铁
D.物质d可能是某有机物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| 甲 | 乙 | 丙 |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池放电时的工作原理如图所示。下列叙述正确的是( )

A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2O===4LiOH
C. B电极反应式为O2+4H++4e-===2H2O
D. 电解液a可以为氯化锂溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下:2NO(g) ![]() N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)
N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)/ c(NO)
B.常温下,NO、H2O、CO2三种化合物分解放出O2的进行程度由大到小的顺序为NO>H2O>CO2
C.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某硫酸试剂标签上的部分内容。下列说法错误的是( )

A.常温下,该硫酸可以用铁制容器运输
B.敞口放置的该硫酸因挥发而导致浓度变小
C.该硫酸的物质的量浓度为18.4molL﹣1
D.配制250mL0.4molL﹣1的稀硫酸需取该硫酸约5.4mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.28g乙烯和丙烯中的极性键数目为4NA
B.1.0molCH4与Cl2在光照下反应生成CH3Cl分子数为1.0NA
C.1mol氖气中含有的原子总数为2NA
D.0.1L0.1molL-1MgCl2溶液中的Mg2+数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJmol-1,如图为质子膜H2S 燃料电池的示意图。下列说法正确的是

A.标准状况下,每 11.2 LH2S 参与反应,有1 mol H+经固体电解质膜进入正极区
B.电池工作时,电子从电极b 经过质子膜流向电极 a
C.电路中每流过 4 mol 电子,电池内部释放632 kJ 的热能
D.电极b 上发生的电极反应式为:O2+4e-+2H2O = 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
A.混合气体的压强B.混合气体的平均相对分子质量
C.A的物质的量D.B的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com