
����Ŀ����֪��2H2S��g��+O2��g�� = S2��s��+2H2O��l�� ��H= -632 kJmol-1����ͼΪ����ĤH2S ȼ�ϵ�ص�ʾ��ͼ������˵����ȷ����

A.��״���£�ÿ 11.2 LH2S ���뷴Ӧ����1 mol H+����������Ĥ����������
B.��ع���ʱ�����Ӵӵ缫b ��������Ĥ����缫 a
C.��·��ÿ���� 4 mol ���ӣ�����ڲ��ͷ�632 kJ ������
D.�缫b �Ϸ����ĵ缫��ӦʽΪ��O2+4e-+2H2O = 4OH-
���𰸡�A
��������
�ɻ�ѧ����ʽ![]() ��֪O2������ԭ��ӦΪ�������缫��ӦΪ��
��֪O2������ԭ��ӦΪ�������缫��ӦΪ��![]() ��H2S����������Ӧ��Ϊ��Դ�������缫��ӦΪ��
��H2S����������Ӧ��Ϊ��Դ�������缫��ӦΪ��![]() ���Դ˷�����
���Դ˷�����
A. ��״���£�ÿ 11.2 LH2S ���뷴Ӧ����H2S���ʵ���Ϊ0.5mol���ɵ缫����ʽ![]() ��֪����1 mol H+����������Ĥ��������������A��ȷ��
��֪����1 mol H+����������Ĥ��������������A��ȷ��
B. ��ع���ʱ�����ӴӸ������ⲿ��·�������������Ӿ��缫a������������缫 b����B����
C. ��Ӧ�ɻ�ѧ��ת��Ϊ���ܣ����ͷŵ�����С��632 kJ����C����
D. �缫b �Ϸ����ĵ缫��ӦʽΪ��![]() ����D����
����D����
�ʴ�ѡ��A��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��Ҫ����ѡ�����αװͿ�ϵ����ϵȡ����ܿ�ʯ
��Ҫ����ѡ�����αװͿ�ϵ����ϵȡ����ܿ�ʯ![]() ��
��![]() ��CoO������
��CoO������![]() ��
��![]() ��
��![]() ��
��![]() ����
����![]() ��������ͼ1��
��������ͼ1��

�±��г��˼������������������������pH![]() ��������ȫ����ָ��Һ������Ũ�ȵ���
��������ȫ����ָ��Һ������Ũ�ȵ���![]()
|
|
|
|
| |
��ʼ������pH |
|
|
|
|
|
������ȫ��pH |
|
|
|
|
|
![]() д������ȡ������
д������ȡ������![]() ������Ӧ�����ӷ���ʽ______��
������Ӧ�����ӷ���ʽ______��
![]() ����ȡ�������
����ȡ�������![]() �⣬�ܿ�ʯ�л��ܱ�
�⣬�ܿ�ʯ�л��ܱ�![]() ��ԭ��������______��
��ԭ��������______��
![]() ��
��![]() ��Ŀ��������
��Ŀ��������![]() ��
��![]() �������������ɵIJ��������______��
�������������ɵIJ��������______��
![]() ��������������
��������������![]() ��Һ����
��Һ����![]() ��Һ��Ҫ
��Һ��Ҫ![]() �����½��У����˵ļ��ȷ�ʽΪ______���¶ȿ�����
�����½��У����˵ļ��ȷ�ʽΪ______���¶ȿ�����![]() ��ԭ��Ϊ______��
��ԭ��Ϊ______��
![]()
![]() ��ʵ�鷽�������������������Һ�м���______������
��ʵ�鷽�������������������Һ�м���______������![]() ��Һ���ܵ�
��Һ���ܵ�![]() ʵ������ʹ���Լ���
ʵ������ʹ���Լ���![]() ��Һ��������ȡ��������
��Һ��������ȡ��������![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��������н������·�Ӧ��N2+3H2![]() 2NH3 ��H��0���¶�һ��ʱ������ƽ����ϵ�и����ʵ�Ũ�ȶ����ӵ�ԭ����2������������Ľ���ǣ� ��
2NH3 ��H��0���¶�һ��ʱ������ƽ����ϵ�и����ʵ�Ũ�ȶ����ӵ�ԭ����2������������Ľ���ǣ� ��
A. ƽ��������Ӧ�����ƶ�B. ƽ�����淴Ӧ�����ƶ�
C. NH3�İٷֺ�������D. �����淴Ӧ���ʶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������е�һ����������巢����Ӧ��![]() ƽ��ʱ���A��Ũ��Ϊ0.50mol/L,�����¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ,���A��Ũ��Ϊ0.30mol/L�������й��ж���ȷ����
ƽ��ʱ���A��Ũ��Ϊ0.50mol/L,�����¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ,���A��Ũ��Ϊ0.30mol/L�������й��ж���ȷ����
A.x+y��zB.ƽ��������Ӧ�����ƶ�
C.B��ת���ʽ���D.C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H��һ�ָ�Ч���ݼ�����ϳ�·������ͼ��ͼ��
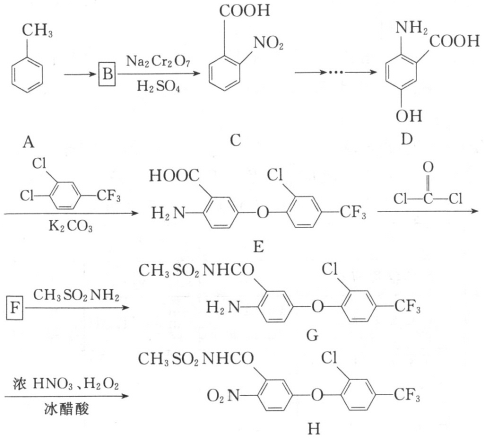
��1��B�ķ���ʽΪ__��
��2��E�к�������������Ϊ___��___��
��3��A��B�ķ�Ӧ����Ϊ___��
��4��д��ͬʱ��������������D��һ��ͬ���칹��Ľṹ��ʽ��___��
�ٲ��ܷ���ˮ�ⷴӦ������FeCl3��Һ������ɫ��Ӧ��
�ڷ�������4�ֲ�ͬ��ѧ�������⡣
��5��F�ķ���ʽΪC15H7ClF3NO4��д��F�Ľṹ��ʽ��___��
��6����֪����NH2�뱽������ʱ���ױ���������COOH�뱽������ʱ������������������Ҫ�������ļ�λ����д����A��DΪԭ���Ʊ�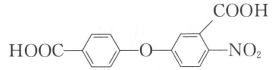 �ĺϳ�·������ͼ___��
�ĺϳ�·������ͼ___��
(���Լ����ã��ϳ�·������ͼʾ�����������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1 mol/L ��ij��Ԫ�� H2A ��Һ�У����ܴ��ڵ����к� A ���ӵ����ʵ��������� pH �仯�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����

A.H2A �ĵ��뷽��ʽ��H2A=H+ + HA��
B.NaHA ��Һ������
C.�����ʵ���Ũ�ȵ� NaHA ��Na2A ��Һ�������ϣ�����Ũ�ȴ�С��ϵΪ��c��Na+����c��A2������c��HA����
D.pH = 5 ʱ����NaHA �� Na2A �Ļ����Һ�У� c��HA���� : c��A2����= 100:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��CuCl�� Ϊ��ɫ��ĩ����¶���ڿ������ױ�����Ϊ��ɫ�ļ�ʽ�Ȼ�ͭCu2��OH��3Cl]��ij��ȤС����¼��ȷֽ��Ȼ�ͭ���壨CuCl2��xH 2O���Ʊ�CuCl����װ�����£������������г�����ʡ�ԣ�
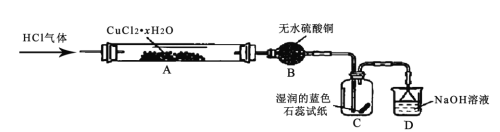
�ش��������⣺
��1��װ����ˮ����ͭ����������Ϊ______��װ�� D ��������______��
��2��ͨ�� HCl �������Ҫ������______��
��3��ʵ������У�װ��C �е�����Ϊ______��
��4��Ӳ�ʲ�����A �з�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________��
��5��Ϊ�ⶨ CuCl2��xH 2O �нᾧˮ����Ŀ x��ʵ�鲽�����£�
a �õ�����ƽ��ȡһ���������Ȼ�ͭ����;
b ������������;
c �ڸ���������ȴ��
d �������ú�ɫ����������
e �ظ� b��d ����ֱ���������γ�����ֵ������ 0.001g��
�����Ȼ�ͭ��������Ϊ 3.384g�����յõ���ɫ��������Ϊ 1.600g���� x=______����ȷ�� 0.1����
��������ʱ�й��彦������������x ֵ______����ƫ����������������ƫС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
(1)�����(�۵�1410 ��)�����õİ뵼����ϡ��ɴֹ��ƴ���������£�
![]()
��������SiCl4(g)�ƴ���ķ�Ӧ�У����ÿ����1.12 kg����������a kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ��___��
(2)����ˮú���ϳɶ����ѵ��ܷ�ӦΪ��3CO(g)��3H2(g) = CH3OCH3(g)��CO2(g) ��H��-246.4 kJ��mol-1�������Է�Ϊ��������Ӧ�ֱ����£�2CO(g)��4H2(g) = CH3OCH3(g)��H2O(g) ��H1����205.1 kJ��mol-1��CO(g)��H2O(g) = CO2(g)��H2(g)����H2��_____����֪CH3OCH3(g)��ȼ����Ϊ1455 kJ��mol��1��д����ʾ��ȼ���ȵ��Ȼ�ѧ����ʽ��__________��
(3)��O2��HClת��ΪCl2�������Ч�棬������Ⱦ��һ�������²�÷�Ӧ������ c(Cl2)���������£�
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
c(Cl2)/10-3 mol/L | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
����2.0��6.0 min��HCl�ķ�Ӧ����Ϊ_____��
(4)��һ���¶��µĶ��������У����������������ٷ����仯ʱ������������ѹǿ�������������ܶȣ����������������ʵ���������������ƽ����Է���������������������ɫ����c(I2):c(H2):c(HI)=1:1:2���������İٷֺ�������˵��I2(g)��H2(g) ![]() 2HI(g)�ﵽƽ��״̬����____��
2HI(g)�ﵽƽ��״̬����____��
(5)�ں��º�ѹ��������ʱ����ӦA��B = C��Dһ�����Է����е���������H__0����S___0(�<������>����=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ĸ���Ӧ����2Na+2H2O=2NaOH +H2������2Na2O2+2H2O=4NaOH+O2������2F2+2H2O=4HF+O2����2H2O![]() 2H2�� +O2��
2H2�� +O2��
��1��ˮֻ������������__��
��2��ˮֻ����ԭ������__��
��3��ˮ����������������ԭ������__��
��4��ˮ�Ȳ����������ֲ�����ԭ������__
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com