
【题目】氯化亚铜(CuCl) 为白色粉末,其露置于空气中易被氧化为绿色的碱式氯化铜Cu2(OH)3Cl]。某兴趣小组高温加热分解氯化铜晶体(CuCl2·xH 2O)制备CuCl,其装置如下(加热仪器、夹持仪器省略)
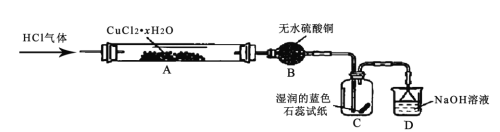
回答下列问题:
(1)装有无水硫酸铜的仪器名称为______,装置 D 的作用是______。
(2)通入 HCl 气体的主要作用是______。
(3)实验过程中,装置C 中的现象为______。
(4)硬质玻璃管A 中发生主要反应的化学方程式为__________。
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=______(精确到 0.1)。
②若加热时有固体溅出坩埚,则测得x 值______填“偏大”“不变”或“偏小”)。
【答案】球形干燥管 吸收Cl2、HCl,防止污染空气 抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气(不写抑制 CuCl2 水解不给分) 先变红,后褪色 2CuCl2xH2O ![]() 2CuCl+Cl2↑ +2xH2O 1.9 偏大
2CuCl+Cl2↑ +2xH2O 1.9 偏大
【解析】
根据已知信息,热分解![]() 制备CuCl,为抑制水解,气体入口需要通入HCl气体,然后加热A处试管,B处球形干燥管中无水硫酸铜变蓝,可以知道
制备CuCl,为抑制水解,气体入口需要通入HCl气体,然后加热A处试管,B处球形干燥管中无水硫酸铜变蓝,可以知道![]() 分解生成了水,由于
分解生成了水,由于![]() 分解生成氯气,因此C处湿润的蓝色石蕊试纸先变红后褪色,D中NaOH溶液可以吸收尾气,防止污染,据此分析回答。
分解生成氯气,因此C处湿润的蓝色石蕊试纸先变红后褪色,D中NaOH溶液可以吸收尾气,防止污染,据此分析回答。
(1)装有无水硫酸铜的仪器名称为球形干燥管;装置 D中NaOH溶液可以吸收Cl2、HCl,防止污染空气,故答案为:球形干燥管;吸收Cl2、HCl,防止污染空气;
(2)![]() 加热时会水解生成碱式氯化铜,通入 HCl 气体的主要作用是抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气,故答案为:抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气;
加热时会水解生成碱式氯化铜,通入 HCl 气体的主要作用是抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气,故答案为:抑制 CuCl2 的水解,并带走水蒸气以及推除装置中空气;
(3)根据上述分析加热分解![]() 时生成Cl2,Cl2遇水生成盐酸和次氯酸,具有酸性和漂白性,C处湿润的蓝色石蕊试纸先变红后褪色,故答案为:先变红,后褪色;
时生成Cl2,Cl2遇水生成盐酸和次氯酸,具有酸性和漂白性,C处湿润的蓝色石蕊试纸先变红后褪色,故答案为:先变红,后褪色;
(4)![]() 高温分解生成CuCl、 Cl2、和H2O,则化学方程式为
高温分解生成CuCl、 Cl2、和H2O,则化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)①最终得到黑色固体为CuO,物质的量为![]() ,由关系式
,由关系式![]() 可知
可知![]() ,解得x=1.9,故答案为:1.9;②若加热时有固体溅出坩埚则最终称量CuO质量偏小,则计算时x偏大,故答案为:偏大。
,解得x=1.9,故答案为:1.9;②若加热时有固体溅出坩埚则最终称量CuO质量偏小,则计算时x偏大,故答案为:偏大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| 甲 | 乙 | 丙 |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.28g乙烯和丙烯中的极性键数目为4NA
B.1.0molCH4与Cl2在光照下反应生成CH3Cl分子数为1.0NA
C.1mol氖气中含有的原子总数为2NA
D.0.1L0.1molL-1MgCl2溶液中的Mg2+数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJmol-1,如图为质子膜H2S 燃料电池的示意图。下列说法正确的是

A.标准状况下,每 11.2 LH2S 参与反应,有1 mol H+经固体电解质膜进入正极区
B.电池工作时,电子从电极b 经过质子膜流向电极 a
C.电路中每流过 4 mol 电子,电池内部释放632 kJ 的热能
D.电极b 上发生的电极反应式为:O2+4e-+2H2O = 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(III)和V(IV)形式存在,由含矾石煤提钒的一种工艺流程如图所示:

已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
(1)含矾石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为__,最佳添加比例为__。

(2)如图为“抽滤”实验原理装置图,"抽滤”时抽气泵的作用是__;“酸浸渣”经“水洗涤”返回“浸出”的目的是__。

(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其离子方程式为__。“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因是__。
(4)“沉钒”的离子反应方程式为___。
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%)。则A点对应物质的化学式为__,B点对应的物质为V2O5,则B点坐标为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )

A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
C(g)+D(g),当下列物理量不再变化时,不能够表明该反应已达平衡状态的是
A.混合气体的压强B.混合气体的平均相对分子质量
C.A的物质的量D.B的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝灰是铝加工行业的废渣,可能含有Al、![]() 、KCl、FeO、
、KCl、FeO、![]() 、MgO、
、MgO、![]() 、
、![]() 中的若干种。为了确认其成分,某同学依次进行了以下实验:
中的若干种。为了确认其成分,某同学依次进行了以下实验:
①将过量的稀盐酸加入铝灰中,充分反应后过滤得到溶液甲和固体乙;
②取少量溶液甲滴加![]() 溶液,生成白色沉淀;
溶液,生成白色沉淀;
③取少量溶液甲滴加KSCN溶液,溶液变成血红色;
④取少量溶液甲加入过量NaOH溶液,置于空气中充分反应后,经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁。
根据以上实验现象或数据,该同学得出的结论正确的是
A.根据①可推出铝灰中一定含有![]() B.根据②可推出铝灰中一定含有KCl
B.根据②可推出铝灰中一定含有KCl
C.根据③可推出铝灰中一定含有![]() D.根据④可推出固体丙中一定不含MgO
D.根据④可推出固体丙中一定不含MgO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com