
【题目】![]() 主要用作选矿剂、伪装涂料的颜料等。用钴矿石
主要用作选矿剂、伪装涂料的颜料等。用钴矿石![]() 含
含![]() 、CoO及少量
、CoO及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() 的流程如图1:
的流程如图1:

下表列出了几种离子生成氢氧化物沉淀的pH![]() “沉淀完全”是指溶液中离子浓度低于
“沉淀完全”是指溶液中离子浓度低于![]()
|
|
|
|
| |
开始沉淀的pH |
|
|
|
|
|
沉淀完全的pH |
|
|
|
|
|
![]() 写出“浸取”步骤
写出“浸取”步骤![]() 发生反应的离子方程式______。
发生反应的离子方程式______。
![]() “浸取”步骤除
“浸取”步骤除![]() 外,钴矿石中还能被
外,钴矿石中还能被![]() 还原的物质有______。
还原的物质有______。
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是______。
的用量过多会造成的不良后果是______。
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为______。温度控制在
条件下进行,适宜的加热方式为______。温度控制在![]() 的原因为______。
的原因为______。
![]()
![]() 的实验方案:向“氧化”后的溶液中加入______,加入
的实验方案:向“氧化”后的溶液中加入______,加入![]() 溶液沉钴得
溶液沉钴得![]() 实验中须使用试剂:
实验中须使用试剂:![]() 溶液、金属萃取剂、盐酸
溶液、金属萃取剂、盐酸![]() 。
。
【答案】![]()
![]() 、
、![]() 与
与![]() 反应生成
反应生成![]() 污染环境或将
污染环境或将![]() 氧化成
氧化成![]() 水浴加热 温度过高
水浴加热 温度过高![]() 易分解,温度过低反应速率缓慢
易分解,温度过低反应速率缓慢 ![]() 溶液,调节溶液的pH至
溶液,调节溶液的pH至![]() ,过滤,向滤液中加入稀盐酸调pH至
,过滤,向滤液中加入稀盐酸调pH至![]() 左右,加入金属萃取剂萃取
左右,加入金属萃取剂萃取![]() 次,静置后分液,得较纯
次,静置后分液,得较纯![]() 溶液
溶液
【解析】
用钴矿石![]() 含
含![]() 、
、![]() 及少量
及少量![]() 、
、![]() 、
、![]() 等
等![]() 生产
生产![]() ,钴矿石加入稀盐酸和亚硫酸钠,铁离子和二氧化锰被亚硫酸钠还原得到亚铁离子和锰离子,加入氯酸钠氧化亚铁离子为铁离子,氧化后的溶液中加入碳酸钠溶液调节溶液的pH至
,钴矿石加入稀盐酸和亚硫酸钠,铁离子和二氧化锰被亚硫酸钠还原得到亚铁离子和锰离子,加入氯酸钠氧化亚铁离子为铁离子,氧化后的溶液中加入碳酸钠溶液调节溶液的pH至![]() ,沉淀铁离子和氯离子,过滤,向滤液中加入稀盐酸调pH至
,沉淀铁离子和氯离子,过滤,向滤液中加入稀盐酸调pH至![]() 左右,滤液中加入萃取剂的作用是除去锰离子,根据图像可知,调节溶液PH在
左右,滤液中加入萃取剂的作用是除去锰离子,根据图像可知,调节溶液PH在![]() 之间,可以除去Co2+中的Mn2+,加入
之间,可以除去Co2+中的Mn2+,加入![]() 溶液沉钴得
溶液沉钴得![]() 。
。
![]() “浸取”步骤
“浸取”步骤![]() 发生反应是在酸溶液中和亚硫酸钠反应生成硫酸钴和水,反应的离子方程式为:
发生反应是在酸溶液中和亚硫酸钠反应生成硫酸钴和水,反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 浸取”步骤
浸取”步骤![]() 能还原
能还原![]() ,氧化铁和二氧化锰也具有氧化性,能和
,氧化铁和二氧化锰也具有氧化性,能和![]() 发生氧化还原反应,故钴矿石中还能被
发生氧化还原反应,故钴矿石中还能被![]() 还原的物质有:
还原的物质有:![]() 、
、![]() ,
,
故答案为:![]() 、
、![]() ;
;
![]() 加
加![]() 的目的是氧化
的目的是氧化![]() ,
,![]() 的用量过多会造成的不良后果是:酸性条件下ClO3-与
的用量过多会造成的不良后果是:酸性条件下ClO3-与![]() 反应生成
反应生成![]() 污染环境或将
污染环境或将![]() 氧化成
氧化成![]() ,
,
故答案为:与![]() 反应生成
反应生成![]() 污染环境或将
污染环境或将![]() 氧化成
氧化成![]() ;
;
![]() “沉钴”步骤向
“沉钴”步骤向![]() 溶液加入
溶液加入![]() 溶液需要
溶液需要![]() 条件下进行,适宜的加热方式为:水浴加热,温度控制在
条件下进行,适宜的加热方式为:水浴加热,温度控制在![]() 的原因是温度过高碳酸氢铵会分解,温度过低反应速率慢,
的原因是温度过高碳酸氢铵会分解,温度过低反应速率慢,
故答案为:水浴加热;温度过高![]() 易分解,温度过低反应速率缓慢;
易分解,温度过低反应速率缓慢;
![]() 氧化后的溶液中含有Fe3+、Al3+、Mn2+、Co2+、Na+、Cl-、SO42-等离子,可以通过调节溶液的PH除去Fe3+和Al3+,根据金属离子沉淀的PH范围的表格可知需要控制溶液的PH在5.2到7.6之间,使Fe3+、Al3+完全沉淀而Co2+不沉淀。Mn2+不能通过调节溶液的PH的方法除去,根据金属萃取剂对金属离子的萃取率与pH的关系图像可知,Mn2+可以用萃取的方法除去,在PH在3.5左右时,Mn2+的萃取率能达到80%以上而Co2+的萃取率不足20%,可以除去Co2+中的Mn2+。根据给出的试剂,调节溶液的PH至
氧化后的溶液中含有Fe3+、Al3+、Mn2+、Co2+、Na+、Cl-、SO42-等离子,可以通过调节溶液的PH除去Fe3+和Al3+,根据金属离子沉淀的PH范围的表格可知需要控制溶液的PH在5.2到7.6之间,使Fe3+、Al3+完全沉淀而Co2+不沉淀。Mn2+不能通过调节溶液的PH的方法除去,根据金属萃取剂对金属离子的萃取率与pH的关系图像可知,Mn2+可以用萃取的方法除去,在PH在3.5左右时,Mn2+的萃取率能达到80%以上而Co2+的萃取率不足20%,可以除去Co2+中的Mn2+。根据给出的试剂,调节溶液的PH至![]() 的试剂用Na2CO3溶液,调节溶液pH至
的试剂用Na2CO3溶液,调节溶液pH至![]() 左右,用的试剂是稀盐酸,
左右,用的试剂是稀盐酸,
故答案为:![]() 溶液,调节溶液的pH至
溶液,调节溶液的pH至![]() ,过滤,向滤液中加入稀盐酸调pH至
,过滤,向滤液中加入稀盐酸调pH至![]() 左右,加入金属萃取剂萃取
左右,加入金属萃取剂萃取![]() 次,静置后分液,得较纯
次,静置后分液,得较纯![]() 溶液。
溶液。


科目:高中化学 来源: 题型:
【题目】近年来,随着工业、科技的迅速发展,氢气的用途越来越广,对氢气纯度的要求也越来越高,高纯氢的制备成为热点。利用太阳能光伏电池电解水制高纯氢的工作示意图如下,该装置通过控制开关连接K1或K2,可交替得到H2和O2,下列叙述不正确的是
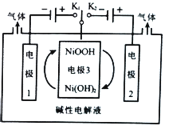
A.开关连接K1时,“电极1”一端产生氢气
B.产生氧气的电极反应为:4OH--4e-=2H2O+O2↑
C.开关连接K1或K2时,“电极3”上NiOOH和Ni(OH)2相互转化,实现循环使用
D.开关与K1相连时,“电极3”的反应为:Ni(OH)2+OH-+e-=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中绚丽的颜色变化往往展现了化学的神奇,体现了化学之美。下列变化中的a、b、c、d可以是混合物,关于物质类别或者反应类型的叙述一定正确的是
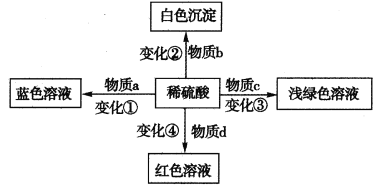
A.变化①一定不属于氧化还原反应
B.变化②得到的白色沉淀一定是硫酸盐
C.物质c中一定不能含有铁红或磁性氧化铁
D.物质d可能是某有机物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可分为许多种,如燃烧热和中和热等。
(1)10g氢气燃烧生成气态水,放出1209kJ热量,若H2O(1)=H2O(g) △H=+44kJ/mol,写出表示氢气燃烧热的热化学方程式:______。
(2)利用50mL0.25molL-1硫酸、50mL 0.55molL-1NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
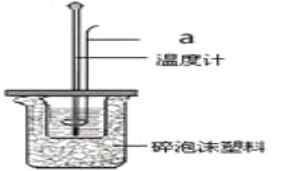
①仪器a的名称是_____。
②使用下列用品不是为了减小实验误差的是______。
A.两个量筒 B.仪器a C.泡沫塑料板 D.碎泡沫塑料
③向装有盐酸的小烧杯中倒入NaOH溶液的正确操作是____。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
④假设硫酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1,△t=3.4℃,该实验测得的中和热数值为____。(保留一位小数)
⑤下列操作不会使测量的中和热数值改变的是___。
A.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
B.结合日常生活实际该实验在保温杯中进行
C.用 0.275molL-1Ba(OH)2溶液代替氢氧化钠溶液
D.把仪器a改为铜制品
E.用60mL 0.5molL-1盐酸与50mL 0.55molL-1 NaOH溶液反应
F.用0.5molL-1醋酸代替硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)
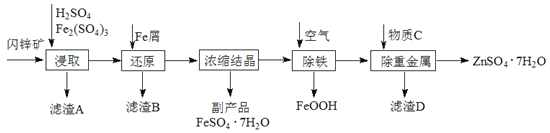
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为________。
(2)浸取过程中Fe2(SO4)3的作用是_______________,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为____________________________________________。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为_______________________。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是____________________________________。
(4)置换法除重金属离子是Cd2+,所用物质C为_________。
(5)硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为__________、__________、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶3的 CuSO4和 NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A. ①②③B. ①②④C. ②③④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
| 甲 | 乙 | 丙 |
A | Al | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SiO2 | NaOH | HF |
D | SO2 | Ca(OH)2 | NaHCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池放电时的工作原理如图所示。下列叙述正确的是( )

A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2O===4LiOH
C. B电极反应式为O2+4H++4e-===2H2O
D. 电解液a可以为氯化锂溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJmol-1,如图为质子膜H2S 燃料电池的示意图。下列说法正确的是

A.标准状况下,每 11.2 LH2S 参与反应,有1 mol H+经固体电解质膜进入正极区
B.电池工作时,电子从电极b 经过质子膜流向电极 a
C.电路中每流过 4 mol 电子,电池内部释放632 kJ 的热能
D.电极b 上发生的电极反应式为:O2+4e-+2H2O = 4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com