
环境污染中除了有害气体产生的空气污染外,重金属离子在溶液中引起的水体污染也相当严重.近年来城市汽车拥有量呈较快增长趋势,汽车尾气的主要有害成分一氧化碳和氮氧化物加重了城市空气污染.研究NO2、SO2、CO等大气污染气体的处理及研究重金属离子水污染的处理具有非常重要的意义.
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体.将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,若测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= .
(2)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例).
已知:NO不能与Na2CO3溶液反应.
NO+NO2+Na2CO3=2NaNO2+CO2;2NO2+Na2CO3=NaNO2+NaNO3+CO2
用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为 .
(3)如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的 极(选填“正”或“负”).写出B极电极反应式 .
 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知:
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.用离子方程式表示溶液pH不能超过10的原因 .
(5)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示.则B点时剩余固体的成分是 (填化学式).
(1)2.67或8/3(2分)
(2)1∶7(2分)
(3)负(2分) O2+4e-+2CO2=2CO32-(2分)
(4)Cr(OH)3+OH-=CrO2-+2H2O(2分)
(5)Cr2O3(2分)
解析试题分析:(1)设原来NO2、SO2的体积分别是1L、2L,参加反应的二氧化氮的体积是x,
NO2 + SO2 
 SO3 + NO
SO3 + NO
开始 1L 2L 0 0
反应 x x x x
平衡 (1-x)(2-x) x x
平衡时NO2与SO2体积比为1:6,即(1-x):(2-x)=1:6,所以x=0.8
平衡常数K=x?x/(1?x).(2?x)= 8/3
(2)①(NO+NO2)+Na2CO3=2NaNO2+CO2 △m
1 mol 32g
②2NO2+Na2CO3=NaNO2+NaNO3+CO2 △m
2mol 48g
根据差量法可得:32g 4
44
48g 12
①和②按1:3进行,所以NO和NO2体积比=1:7
(3)A电极发生氧化反应,作负极,B电极为:O2+4e-+2CO2=2CO32-;(4)pH超过10时,Cr(OH)3会与OH-形成CrO2-,离子方程式为:Cr(OH)3+OH-=CrO2-+2H2O;(5)根据图像所给剩余固体的质量计算可得B点时剩余固体的成分是Cr2O3。
考点:常见的生活环境的污染及治理、化学电源新型电池、离子方程的书写、化学方程式的计算等知识。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:填空题
(Ⅰ)下列操作会导致实验结果偏高的是 。
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线
B.在配制一定物质的量浓度溶液时,用10 mL的量筒量取5.0 mL液体溶质时俯视读数
C.用天平称量20.5 g某物质,砝码和药品的位置放反,所得药品的质量
D.配制一定物质的量浓度的溶液时,定容时俯视读数,所得溶液的浓度
(Ⅱ)现有下列仪器或用品:
a铁架台(含铁圈、铁夹);b锥形瓶;c滴定管;d烧杯(若干);e玻璃棒;f胶头滴管;g托盘天平(含砝码);h滤纸;i量筒;j漏斗;k温度计
现有下列试剂:
A.NaOH固体 B.碳酸钠溶液
C.氯化镁溶液 D.蒸馏水
试填空:
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是 。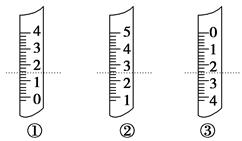
A.①是量筒,读数为1.5 mL
B.②是量筒,读数为2.50 mL
C.③是滴定管,读数为2.50 mL
D.①是温度计,读数是1.50 ℃
(2)配制100 mL 0.1 mol·L-1的氢氧化钠溶液时,还缺少的仪器有 。
(3)除去Mg(OH)2中混有的少量Ca(OH)2,可以用到的试剂是 (选填序号),操作方法是 、 、洗涤。
完成上述操作,上述仪器或用品用到的有 (从上述仪器或用品中选择,填上相应序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校化学小组学生进行“气体相对分子质量的测定”的实验。操作如下:用质量和容积都相等的烧瓶收集气体,称量收集满气体的烧瓶质量,数据见下表(已换算成标准状况下的数值)。
| 气体 | 烧瓶和气体的总质量(g) |
| A | 48.4082 |
| B | 48.4082 |
| C | 48.4082 |
| D | 48.4342 |
| E | 48.8762 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。
I尾气的吸收和综合利用。
以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下: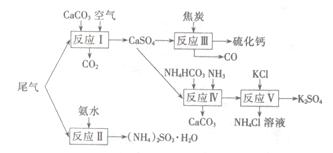
(1)反应III中氧化剂与还原剂的物质的量之比为 。
(2)反应Ⅳ的化学方程式为 。
(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为 。
Ⅱ催化剂的回收利用。
SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下: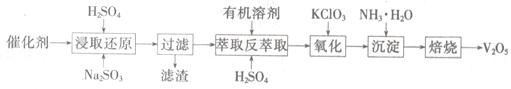
(4)若反萃取使用的硫酸用量过大,进一步处理时会增加____ 的用量。
(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为 。
氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化氢溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是 (填代号)。
A.Na2O2+2HCl 2NaCl+H2O2 2NaCl+H2O2 |
B.Ag2O+H2O2 2Ag+O2↑+H2O 2Ag+O2↑+H2O |
C.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
D.3H2O2+Cr2(SO4)3+10KOH 2K2CrO4+3K2SO4+8H2O 2K2CrO4+3K2SO4+8H2O |

 A+NH3↑,试指出生成物A的化学式为 。
A+NH3↑,试指出生成物A的化学式为 。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: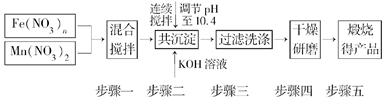
(1)原料Fe(NO3)n中n=________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为________。
(2)步骤二中“连续搅拌”的目的是__________________________________________
步骤三中洗涤干净的标准是________________________________________________
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4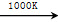 MnFe2O4-x+O2↑;
MnFe2O4-x+O2↑;
MnFe2O4-x+xH2O MnFe2O4+xH2↑
MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为________。
②该热化学循环制氢法的优点有_____________________、________________________ (答两点即可)。
该热化学循环法制氢尚有不足之处,进一步改进的研究方向是___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。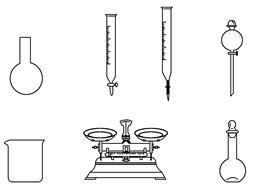
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范围 ;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)将ag氯化钙溶于1.8L水中,恰好使钙离子数与水分子数之比为1:100,则a值为 。
(2)在反应2A+B=3C+2D中,已知3.4gA与3.2gB完全反应,生成4.8gC,又知道D的式量为18,则B的式量是
(3)25.4g 某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是 。
(4) 某混合物由Na2SO4、Al2(SO4)3组成,已知Na、Al两元素的质量之比为23: 9,则Na2SO4和Al2(SO4)3物质的量之比为 ,含1.00mol SO42–的该混合物的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com