
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。

 N2O4(g) ΔH < 0,该反应为放热反应,升高温度,化学平衡逆向移动,NO2的体积分数增大;增大压强,化学平衡正向移动,NO2的体积分数减小。①由图象可知,A、C两点均在温度为T2的等温线上,C的压强大,则A、C两点的反应速率:A<C,错误;②由图象可知,C的压强大,体积小,则C各物质的浓度大,则a、c两点气体的颜色:A浅,C深,错误;③B、C两点的气体的体积分数相等,平均分子质量:B=C,错误;④升高温度,化学平衡逆向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,正确;选④;(5)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+;②B为电解池,铜离子发生还原反应,在阴极析出,转移0.2mol电子,析出铜的物质的量为0.1mol,质量为6.4g。
N2O4(g) ΔH < 0,该反应为放热反应,升高温度,化学平衡逆向移动,NO2的体积分数增大;增大压强,化学平衡正向移动,NO2的体积分数减小。①由图象可知,A、C两点均在温度为T2的等温线上,C的压强大,则A、C两点的反应速率:A<C,错误;②由图象可知,C的压强大,体积小,则C各物质的浓度大,则a、c两点气体的颜色:A浅,C深,错误;③B、C两点的气体的体积分数相等,平均分子质量:B=C,错误;④升高温度,化学平衡逆向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,正确;选④;(5)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+;②B为电解池,铜离子发生还原反应,在阴极析出,转移0.2mol电子,析出铜的物质的量为0.1mol,质量为6.4g。

 习题精选系列答案
习题精选系列答案科目:高中化学 来源:不详 题型:单选题
| A.NaOH固体溶于水 |
| B.煅烧石灰石制生石灰 |
| C.Ba(OH)2?8H2O晶体与NH4Cl晶体混合、不断搅拌 |
| D.CO2通过炽热的碳层 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g); 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
| A.加入催化剂 | B.降低温度 |
| C.分离出H2O(g) | D.增大压强 |
 O2+Hb·CO K=220
O2+Hb·CO K=220查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | | 6 | 8 |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 | 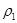 | 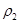 | |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
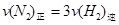 d.混合气体的密度保持不变
d.混合气体的密度保持不变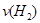 =
= 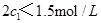 b.氮气的转化率:
b.氮气的转化率: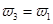 c.
c. 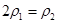 d.
d.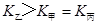
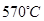 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.194 | B.391 | C.516 | D.658 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ① CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ② CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③ O2(g)
O2(g)  CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是 反应(填“自发”或“非自发”)。 CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH= 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com