
【题目】将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+ , 待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,则KNO3的还原产物( )
A.NO
B.NO2
C.N2O
D.N2O3
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 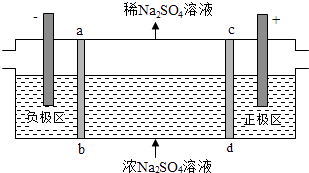
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为Va、Vb,,则Va、Vb的关系正确的是 ( )
A. Va>10 Vb B. Va=10 Vb C. Vb <10Va D. Vb >10Va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(O3)的制备方法很多,其中电解水法的原理如图所示,下列有关说法不正确的是( ) 
A.可向水中加入NaCl提高水的导电性
B.b电极周围pH减小
C.a电极的电极反应式为2H++2e﹣═H2↑
D.a电极为阴极,b电极为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下: 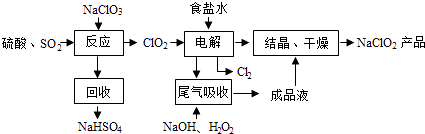
回答下列问题:
(1)NaClO2中Cl的化合价为 .
(2)写出“反应”步骤中生成ClO2的化学方程式 .
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+ , 要加入的试剂分别为、 . “电解”中阴极反应的主要产物是 .
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2 . 此吸收反应中,氧化剂与还原剂的物质的量之比为 , 该反应中氧化产物是 .
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力.NaClO2的有效氯含量为 . (计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蛋白酶的叙述,不正确的是( )
A. 蛋白酶是蛋白质
B. 蛋白酶的最适pH值是1.9
C. 蛋白酶只能水解蛋白质
D. 蛋白酶在100℃时完全失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧、硫、硒、碲都位于元素周期表的VIA族,其化合物在化工生产中有广泛应用。
(1)下列性质的递变顺序不正确的是_____(填字母)。
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为_________。
②若V是水,为还原产物,反应的化学方程式为_____________。
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g)![]() S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______(填字母)。
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______(填字母)。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C. ![]() 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等
②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:______________。
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为____________。
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为_____;阳极产生的气体是_____ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的说法正确的是( )
A.铝箔在空气中受热可以熔化且会发生剧烈燃烧
B.Na在空气中燃烧,发出黄色火焰,生成白色固体
C.铁与水蒸气反应的产物是黑色的Fe2O3
D.铝制餐具不能用来盛装酸、碱、咸的食物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com