
【题目】氧、硫、硒、碲都位于元素周期表的VIA族,其化合物在化工生产中有广泛应用。
(1)下列性质的递变顺序不正确的是_____(填字母)。
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为_________。
②若V是水,为还原产物,反应的化学方程式为_____________。
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g)![]() S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______(填字母)。
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______(填字母)。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C. ![]() 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等
②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:______________。
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为____________。
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为_____;阳极产生的气体是_____ (填化学式)。
【答案】 DE 2F2+2H2O=O2+4HF O2+2H2S=2S↓+2H2O BD CS2(l)+3O2(g)=CO2(g)+2SO2(g) ΔH=-1076.8 kJ·mol-1 2∶1 TeO32-+4e+3H2O=Te+6OH- O2
【解析】(1) A.同一元素的含氧酸,元素的化合价越高,酸性越强,酸性H2SeO4>H2SeO3 ,故A正确;B. 同一主族元素从上到下,元素的非金属性逐渐减弱,非金属性:O>S>Se>Te,故B正确;C.元素的非金属性越强,对应离子的还原性越弱,还原性:H2Te>H2Se>H2S>H2O,故C正确;D. 元素的非金属性越强,氢化物的稳定性越强,热稳定性:H2O >H2S >H2Se>H2Te,故D错误;E.水分子间能够形成氢键,水的沸点最高,故E错误;故选DE;
(2) ①W是水,作还原剂,则X是氧化剂,且是单质,能和水反应且作氧化剂的短周期元素单质是氟气,氟气和水反应的化学反应方程式为:2F2+2H2O═O2+4HF,故答案为:2F2+2H2O═O2+4HF;
②V是水,则W为氢化物,且X为O2,符合条件的置换反应为O2+2H2S=2H2O+2S↓,故答案为:O2+2H2S=2H2O+2S↓;
(3) ①A.反应中的物质均为气体,混合气体的密度始终不变,不能判断反应达到平衡状态,错误;B.反应前后气体的物质的量发生变化,混合气体的压强不再变化,说明气体的物质的量不变,能够判断反应达到平衡状态,正确;C. ![]() 始终为2:1,不能判断反应达到平衡状态,错误;D.H2S与H2的消耗速率相等,说明正逆反应速率相等,能够判断反应达到平衡状态,正确;故选BD;
始终为2:1,不能判断反应达到平衡状态,错误;D.H2S与H2的消耗速率相等,说明正逆反应速率相等,能够判断反应达到平衡状态,正确;故选BD;
②液态CS2完全燃烧生成CO2、SO2气体,反应的方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g),根据O元素化合价的变化,反应中转移的电子数为12,每转移3mol电子时放出269.2kJ热量,则转移12mol电子放出热量269.2kJ×4=1076.8 kJ,因此热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g) ΔH=-1076.8 kJ·mol-1,故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g) ΔH=-1076.8 kJ·mol-1;
(4) ①工业上,用SO2还原TeC14溶液制备碲(Te),反应的方程式为2SO2+TeC14+ 4H2O =Te+2H2SO4+4HCl,其中氧化产物为硫酸,还原产物为Te,物质的量之比为2:1,故答案为:2:1;
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极发生还原反应,电极反应式为TeO32-+4e+3H2O=Te+6OH-;阳极发生氧化反应,溶液中的氢氧根离子放电生成氧气,故答案为:TeO32-+4e+3H2O=Te+6OH-;O2。


科目:高中化学 来源: 题型:
【题目】把5.1 g镁铝合金的粉末放入过量的盐酸中,得到5.6 L H2(标准状况下)。试计算:
(1)该合金中铝的质量分数_____________(保留一位小数);
(2)该合金中铝和镁的物质的量之比__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+ , 待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,则KNO3的还原产物( )
A.NO
B.NO2
C.N2O
D.N2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置实验,下列实验现象预期及相应结论均正确的是( )
a | b | 实验现象预期 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置F、I中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 装置J收集的气体中一定不含NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。
方案I:利用FeO吸收CO2获得H2
ⅰ.6FeO(s)+CO2(g)=--2Fe3O4(s)+C(s) △H1=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) △H2=+113.4kJ/mol
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=________。
(2)在反应i中,每放出38.0kJ热量,有_______gFeO被氧化。
方案II:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2和8molH2,发生反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
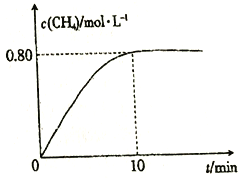
(3) ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=_________。
②300℃时,反应的平衡常数K=____________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度_________(填字母)。
A.等于0.8mol/L B.等于1.6 mol/L C.0.8 mol/L <c(CH4)<1.6 mol/L D.大于1.6 mol/L
(4)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g),则v正____v逆(填“>”“<”或“=”)。
(5)已知:200℃时,该反应的平衡常数K=64.8L2·mol-2。则△H4______0(填“>”“<”或“=”)。
方案Ⅲ:用碱溶液吸收CO2
利用100mL3mol/LNaOH溶液吸收4.48LCO2(标准状况),得到吸收液。
(6)该吸收液中离子浓度的大小排序为______________。将该吸收液蒸干、灼烧至恒重,所得固体的成分是__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的、酸性溶液中,能共存的离子组是( )
A.Na+ 、K+、SO42-、CO32-B.Na+、 K+、Cl、 NO3
C.Cu2+、K+、SO42-、NO3D.Ba2+、K+、Cl、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A. 可用托盘天平和小烧杯称取 10.2 g NaOH固体
B. 某实验需要 900 mL 0.1 mol/L的硫酸铜溶液,则配制该溶液需称取 22.5 g 胆矾晶体
C. 用 10 mL 量筒量取 5.2 mL 硫酸,仰视时实际量得的液体体积大于 5.2 mL
D. 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com