
【题目】活细胞中数量最多的元素是( )
A. O B. H C. N D. C
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 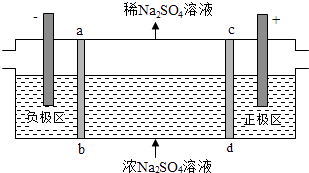
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蛋白酶的叙述,不正确的是( )
A. 蛋白酶是蛋白质
B. 蛋白酶的最适pH值是1.9
C. 蛋白酶只能水解蛋白质
D. 蛋白酶在100℃时完全失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧、硫、硒、碲都位于元素周期表的VIA族,其化合物在化工生产中有广泛应用。
(1)下列性质的递变顺序不正确的是_____(填字母)。
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为_________。
②若V是水,为还原产物,反应的化学方程式为_____________。
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g)![]() S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______(填字母)。
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______(填字母)。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C. ![]() 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等
②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:______________。
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为____________。
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为_____;阳极产生的气体是_____ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A. Na2CO3溶液与足量盐酸反应:CO![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
B. FeCl2溶液和Cl2反应:2Fe2++Cl2===2Fe3++2Cl-
C. 钠与水反应:Na+H2O===Na++OH-+H2↑
D. NaHCO3溶液与稀硝酸反应:HCO![]() +H+===CO2↑+H2O
+H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用氯化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:
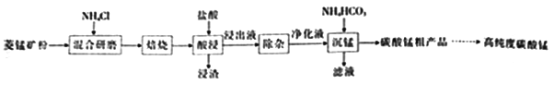
己知相关信息如下:
①菱猛矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3 2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应MnCO3+2NH4Cl=MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:
难溶物 | Mn(OH)2 | MnCO3 | CaF2 | MgF2 |
Ksp | 2.0×10-13 | 2.0×10-11 | 2.0×10-10 | 7.0×10-11 |
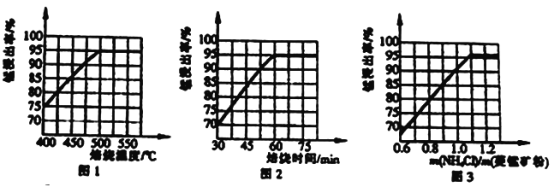
(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(美锰矿粉)分别为____、____、____。
(2) “除杂”过程如下:
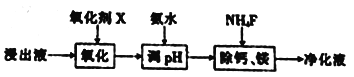
①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O3>H2O2 >Cl 2>MnO2 >Fe2+,则氧化剂X宜选择_________(填字母)。
A. (NH4)2S2O3 B. MnO2 C. H2O2 D. Cl 2
②调节pH时,pH 可取的最低值为_____________。
③当CaF2、MgF2两种沉淀共存时,若溶液中c(Ca2+)=1.0×10-3mol/L,则c(Mg2+)=____mol/L。
(3)“沉锰”过程中,不用碳酸纳溶液替代NH4HCO3溶液,可能的原因是__________。
(4)测定碳酸锰粗产品的纯度。实验步骤:
①称取0.5000g碳酸锰粗产品于300mL锥形瓶中,加少量水湿润,再加25mL磷酸,移到通风橱内加热至240℃,停止加热,立即加入2 g硝酸铵,保温,充分反应后,粗产品中的碳酸锰全部转化为[Mn(PO4)2]3-,多余的硝酸铵全部分解。用氮气赶尽锥形瓶内的氮氧化物,冷却至室温。
②将上述锥形瓶中的溶液加水稀释至100mL,滴加2-3滴指示剂,然后用浓度为0.2000mol/L的硫酸亚铁铵[(NH4)Fe(SO4)2]标准溶液滴定,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-。到达滴定终点时,消耗的硫酸亚铁铵标准溶液的体积为20.00mL。
计算:碳酸锰粗产品的纯度=___________。
误差分析:若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_____(填“偏高”“偏低”或 “无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.
(1)C离子的结构示意图为_______.D在周期表中________位置.
(2)A、D两元素形成的化合物属________(填“离子”或“共价”)化合物..
(3)写出E的电子式:________..
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的说法正确的是( )
A.铝箔在空气中受热可以熔化且会发生剧烈燃烧
B.Na在空气中燃烧,发出黄色火焰,生成白色固体
C.铁与水蒸气反应的产物是黑色的Fe2O3
D.铝制餐具不能用来盛装酸、碱、咸的食物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com