
【题目】工业上采用氯化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:
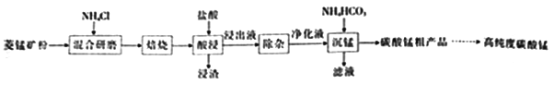
己知相关信息如下:
①菱猛矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3 2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应MnCO3+2NH4Cl=MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:
难溶物 | Mn(OH)2 | MnCO3 | CaF2 | MgF2 |
Ksp | 2.0×10-13 | 2.0×10-11 | 2.0×10-10 | 7.0×10-11 |
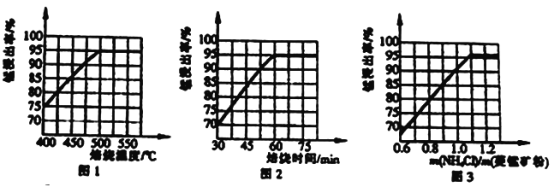
(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(美锰矿粉)分别为____、____、____。
(2) “除杂”过程如下:
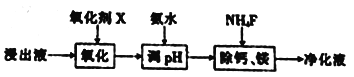
①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O3>H2O2 >Cl 2>MnO2 >Fe2+,则氧化剂X宜选择_________(填字母)。
A. (NH4)2S2O3 B. MnO2 C. H2O2 D. Cl 2
②调节pH时,pH 可取的最低值为_____________。
③当CaF2、MgF2两种沉淀共存时,若溶液中c(Ca2+)=1.0×10-3mol/L,则c(Mg2+)=____mol/L。
(3)“沉锰”过程中,不用碳酸纳溶液替代NH4HCO3溶液,可能的原因是__________。
(4)测定碳酸锰粗产品的纯度。实验步骤:
①称取0.5000g碳酸锰粗产品于300mL锥形瓶中,加少量水湿润,再加25mL磷酸,移到通风橱内加热至240℃,停止加热,立即加入2 g硝酸铵,保温,充分反应后,粗产品中的碳酸锰全部转化为[Mn(PO4)2]3-,多余的硝酸铵全部分解。用氮气赶尽锥形瓶内的氮氧化物,冷却至室温。
②将上述锥形瓶中的溶液加水稀释至100mL,滴加2-3滴指示剂,然后用浓度为0.2000mol/L的硫酸亚铁铵[(NH4)Fe(SO4)2]标准溶液滴定,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-。到达滴定终点时,消耗的硫酸亚铁铵标准溶液的体积为20.00mL。
计算:碳酸锰粗产品的纯度=___________。
误差分析:若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_____(填“偏高”“偏低”或 “无影响”)。
【答案】 500℃ 60min 1.1 B 4.7 3.5×10-6 碳酸钠溶液中的c(OH-)较大,会产生Mn(OH)2沉淀 92.00% 偏低
【解析】(1)图1随着温度升高锰浸出率增大,到500℃达最高为95%,图2随着时间的增大,锰浸出率增大,到60min达最大为95%,图3随着m(NH4Cl)/m(美锰矿粉)增大,锰浸出率增大,到1.1达最大为95%,最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(美锰矿粉)分别为500℃、60min、1.1;(2)①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O3>H2O2>Cl2>MnO2>Fe2+,氧化剂X的加入是为了将亚铁离子氧化为铁离子,铁离子水解产生氢氧化铁而除去,试剂的加入不能引入新的杂质,宜选择MnO2,反应产生锰离子,且过量时不溶可随沉淀过滤除去,答案选B;②调节pH时,是为了除去氧化后溶液中的Al3+、Fe3+,必须使Al3+、Fe3+完全沉淀,则pH可取的最低值为4.7;③当CaF2、MgF2两种沉淀共存时,若溶液中c(Ca2+)=1.0×10-3mol/L,则c2(F-)= =
=![]() =2.0×10-7,c(Mg2+)=
=2.0×10-7,c(Mg2+)=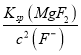 =
=![]() =3.5×10-6mol/L;(3)碳酸钠溶液中的c(OH-)较大,会产生Mn(OH)2沉淀,故“沉锰”过程中,不用碳酸纳溶液替代NH4HCO3溶液;(4)①设碳酸锰粗产品的纯度为x,根据锰原子守恒及反应[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-可得关系式为:
=3.5×10-6mol/L;(3)碳酸钠溶液中的c(OH-)较大,会产生Mn(OH)2沉淀,故“沉锰”过程中,不用碳酸纳溶液替代NH4HCO3溶液;(4)①设碳酸锰粗产品的纯度为x,根据锰原子守恒及反应[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-可得关系式为:
MnCO3~~~~~ Mn2+~~~~~~~ Fe2+~~~~~~~~~(NH4)Fe(SO4)2
115g 1mol
0.5000xg 0.2000mol/L×20.00mL×10-3L/mL=4.0×10-3 mol
![]() =
=![]() ,解得x=92.00%;若滴定终点时发现滴定管尖嘴处产生了气泡,则所用标准液的体积读数偏小,根据c(待测)=
,解得x=92.00%;若滴定终点时发现滴定管尖嘴处产生了气泡,则所用标准液的体积读数偏小,根据c(待测)=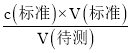 可知,测得的碳酸锰粗产品的纯度偏低。
可知,测得的碳酸锰粗产品的纯度偏低。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+l)。下列有关元素X的说法中,不正确的是()
A. 元素X的原子核内质子数可能为(2a2-l)
B. 元素X形成的单质既能作氧化剂又能作还原剂
C. 元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
D. 由元素X形成的某些化合物,可能具有杀菌消毒的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置实验,下列实验现象预期及相应结论均正确的是( )
a | b | 实验现象预期 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。
方案I:利用FeO吸收CO2获得H2
ⅰ.6FeO(s)+CO2(g)=--2Fe3O4(s)+C(s) △H1=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) △H2=+113.4kJ/mol
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=________。
(2)在反应i中,每放出38.0kJ热量,有_______gFeO被氧化。
方案II:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2和8molH2,发生反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
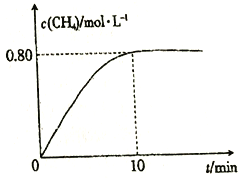
(3) ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=_________。
②300℃时,反应的平衡常数K=____________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度_________(填字母)。
A.等于0.8mol/L B.等于1.6 mol/L C.0.8 mol/L <c(CH4)<1.6 mol/L D.大于1.6 mol/L
(4)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g),则v正____v逆(填“>”“<”或“=”)。
(5)已知:200℃时,该反应的平衡常数K=64.8L2·mol-2。则△H4______0(填“>”“<”或“=”)。
方案Ⅲ:用碱溶液吸收CO2
利用100mL3mol/LNaOH溶液吸收4.48LCO2(标准状况),得到吸收液。
(6)该吸收液中离子浓度的大小排序为______________。将该吸收液蒸干、灼烧至恒重,所得固体的成分是__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法操作,能达到要求的是( )
A.用托盘天平称量25.20g氯化钠固体
B.用100 mL量筒量取5.20 mL盐酸
C.用一束强光照射经过煮沸的三氯化铁溶液有光亮的通路,说明已生成氢氧化铁胶体
D.过量的铁丝在氯气中点燃,可制取氯化亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的、酸性溶液中,能共存的离子组是( )
A.Na+ 、K+、SO42-、CO32-B.Na+、 K+、Cl、 NO3
C.Cu2+、K+、SO42-、NO3D.Ba2+、K+、Cl、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。

(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:lg C(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述不正确的是 ( )

A. 碳[C(s)]的燃烧热△H< -110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O吸收73kJ的热量
C. 2Cu2O(s)+O2(g)=4CuO(s) △H=-292 kJ·mol-1
D. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H= -35.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com